用于靶向药物递送到癌细胞的微胶囊

来自彼得大帝圣彼得堡理工大学(Peter the Great St.Petersburg Polytechnic University, SPbPU)的一组科学家与他们的同事一起开发了一种靶向药物递送到癌细胞的方法。这项发现是基于使用间充质干细胞和由高分子化合物制成的微胶囊。研究结果发表在生物材料科学日报》。在未来,这一发现可能使肿瘤在不损害健康组织的情况下得到更精确的治疗。
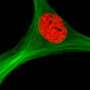
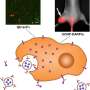
不同类型的组织,包括脂肪,肌肉,软骨和骨骼,起源于间充质干细胞(MSC)。此外,这些细胞可以迁移到肿瘤并与肿瘤发生反应。其原因是肿瘤主动释放的一种类似蛋白质的化学因子。趋化因子吸引在其表面有特定受体的细胞,这些细胞的迁移与趋化因子浓度的增长一致。MSC表面的CXCR4受体与SDF-1趋化因子反应,使细胞向肿瘤靠近。
“基于活细胞的药物传递系统的开发是生物医学中的一个迫切问题。这一策略提供了能够对肿瘤反应的细胞培养的使用。msc被认为是最有前途的一个潜在的药物中交付平台,因为他们是相对容易获得和成长在一个实验室,”解释Timofey卡尔波夫,协作开发的方法,在实验室助理微型胶囊和控制交付生物活性化合物,RASA-SPbPU中心。
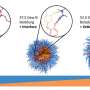
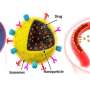
这种新技术可以将不同的生物活性物质组合在一起,包括抗癌药物。该团队选择长春新碱作为样本药物,因为它影响不同类型的生长,并积极用于化疗。长春新碱被放入由高分子化合物和金纳米棒制成的特殊微胶囊中。通过吞噬作用,胶囊进入骨髓间充质干细胞内,然后对细胞进行处理红外线它能穿透组织而不损伤组织。因此,胶囊中的金颗粒吸收了大量的能量并被加热。热量破坏了高分子结构,然后药物被释放到MSCs中。部分长春新碱残留在细胞内,部分进入细胞间隙,影响肿瘤。
“合成亚微米级聚合胶囊的新技术提供了不同生物活性物质的包装。在此基础上,可以开发出各种抗肿瘤物质的输送平台,也可以为现代医学的不同领域创造药物。红外线已经被广泛使用了很长时间,当照射参数设置正确时几乎是无害的,”Timofey Karpov说。
有针对性的药物输送能否通过减少化疗对健康的负面影响来减少化疗的毒性作用细胞。
进一步探索












用户评论