研究揭示了关键脑受体复合物的奥秘
脑大脑中称为AMPars的谷氨酸受体对于突触可塑性,学习和记忆至关重要。功能不佳的安培具有与各种神经系统和精神病疾病有关,包括癫痫发作,阿尔茨海默病,重大抑郁和自闭症谱系障碍。
了解AMPARS如何形成和操作对于药理化合物的理性设计至关重要,即通过调整AMPAR活动的上下或向下调整AMPAR活动,可以改善对这些条件的治疗。
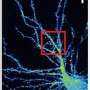
为此,范德比尔特大学的Terunaga Nakagawa,医学博士,12月6日在杂志上报道科学与称为CNIH3的辅助亚基的复合物中的AMPAR的第一结构。使用称为冷冻电子显微镜的技术获得这些潜在的新药物靶标。
中川是范德比尔特大学医学院分子生理学和生物物理学副教授。
AMPARS,用于AMPA型离子型谷氨酸受体的短,是配体门控的离子通道嵌入着由神经递质谷氨酸的神经细胞的膜中。它们产生来自流过它们的带电离子的信号。
反过来,ampar是由膜蛋白与它们形成复合体的辅助亚单位。最丰富的调节因子之一是一个蛋白质家族,称为cornichon (CNIH)。
使用低温-电子显微镜,这产生了非同寻常的高分辨率图像当标本被冷冻以保存其精细结构时,中川能够首次绘制出AMPAR-CNIH3复合物和脂质分子的分子视图。
的结构体揭示膜中CNIH3的折叠与计算算法预测的折叠非常不同。
基于该结构,他假设CNIH3结合位点,靠近形成受体离子“孔”的Glua亚基之一,是可用于控制AMPAR离子通道活性的药物的潜在靶标。
众所周知,他对AMPAR的研究,Nakagawa 14年前开发了一种纯化方法,可以从大脑中分离完整的受体,以便他可以了解这些大分子“机器”如何组织突触的结构和功能。
Jochen Schwenk等。折叠不适当的,科学(2019)。DOI: 10.1126 / science.aaz8642














用户评论