怎么没碰在细胞表面的受体可能影响神经元连接的强度吗
像许多受体浮标在海洋上,漂浮在细胞膜表面的一部分粘在水和另一个水下,在细胞的细胞质中。但对细胞功能,这些受体必须停靠在特定区域的细胞。大多数研究都集中在“水下”部分。这就是细胞的分子机器群和与受体相互作用的水下反面,然后与交互深入细胞核刺激信号,改变细胞的过程。
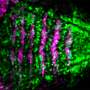
新工作由托马斯杰弗逊大学的一组研究人员揭示了新的活动在水面上,在管理学习和大脑细胞受体慢性疼痛。在这项研究中,作者表明,蛋白质的“水面”部分可以帮助码头的蛋白质在突触,在整个大脑神经元调节信息的流动。这个发现打开的可能性使用这种对接网站作为目标来开发更有效地治疗慢性疼痛和其他疾病。该研究发表在1月29日自然通讯。
“细胞外的“水面”——这个领域,部分已经很大程度上被忽视了,”资深作者马修Dalva说,博士,教授,副主席的神经科学和杰斐逊突触生物学中心主任Vickie &杰克研究所神经科学——杰弗逊的健康。Dalva博士和他的团队研究了NMDAR受体对大脑细胞,发现这个受体与邻居的地方启动信号。“当试图开发新疗法,找到圆心是一半的问题,“Dalva博士说。
找到一个关键交互位于细胞表面之上,可能会使它更易于被治疗。”类型的受体相互作用比当我们谈论不同受体的细胞外配体结合,这是有据可查的,“Dalva博士说。“在这里,我们描述的各种生化exchanges-kinase磷酸化受自由浮动ATP-that我们想,直到最近,独有的细胞里面。”
研究人员专注于突触蛋白NMDA-type谷氨酸受体(NMDARs),这有助于调节神经元之间的突触连接的强度。强烈的突触连接是很重要的,但不要太强烈,为了防止创建一个过度兴奋的连接。
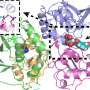
一个关键机制控制突触强度NMDAR功能的增加是由于直接与另一个突触蛋白分子间相互作用EphB受体酪氨酸激酶。Dalva博士和他的同事们曾表明EphB的磷酸化的“外”或细胞外部分分子可能导致与NMDARs直接交互。这导致化学交换受体集群和驱动神经可塑性和慢性疼痛(PlosBiology 2017)。他们的新工作确定的特定区域NMDAR或圆心,这些蛋白质交互所必需的。
这个特定的牛眼灯可以有重要的医学意义,破坏EphB-NMDAR交互与阿尔茨海默氏症有关,而在慢性疼痛可能是由于太多的交互。trans-synaptic组织者和NMDAR结合蛋白,EphB受体是这些事件的主要监管机构。
然而,尽管这种交互的发现在10年前,确切的地方NMDAR与EphB一直是一个谜。这里,研究人员证明特定氨基酸的铰链区NDMAR要求与EphB2交互。重要的是,所需的氨基酸在铰链区突触适当NDMAR流动性和稳定。
“越来越多的证据表明,细胞外的交互可能发挥关键的监管作用在疾病从痛苦到癌症甚至疟疾、“Dalva博士说。”我们开始定义这些交流是什么样子,我们可以学习他们,理解他们的贡献对疾病和潜在使用它们来找到更好的医疗干预措施。”
进一步探索