新的计算工具识别出侵袭性癌症中选择性的剪接变化
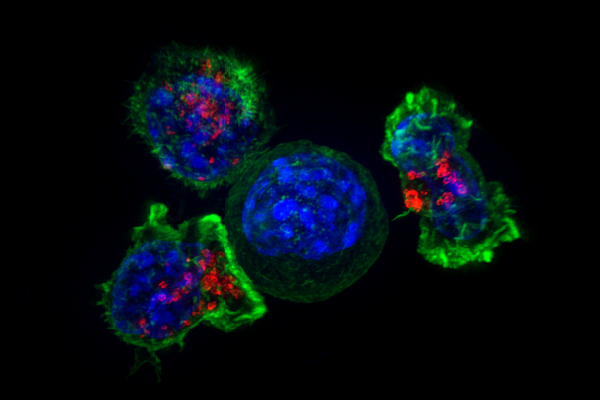
由费城儿童医院(CHOP)领导的多机构研究小组已经将一个强大的癌症驱动基因与调节选择性剪接的蛋白质变化联系起来。研究人员为这项研究创造了新的计算工具和生物模型系统。这项合作研究由CHOP的易兴博士和加州大学洛杉矶分校(UCLA)的Owen Witte博士领导,今天发表在《科学》杂志上美国国家科学院院刊。
“我们的研究提供了对一个重要的癌症驱动基因和选择性剪接变化可用于指导剪接靶向的发展癌症治疗他是CHOP的计算和基因组医学中心主任,也是这项研究的资深作者。
的共同努力包括加州大学洛杉矶分校CHOP和罗斯威尔公园综合癌症中心的研究人员。John Phillips,医学博士,加州大学洛杉矶分校研究员,Yang Pan,硕士,CHOP访问学者,加州大学洛杉矶分校研究生,是这项研究的第一作者。
选择性剪接是一个必要的过程,它允许一个基因在翻译成蛋白质之前,根据RNA被剪切或剪接的位置为许多基因产物编码。癌细胞经常利用这一过程产生促进生长和存活的蛋白质,使它们能够不受控制地复制和转移。这发生在许多癌症中,包括前列腺癌,这与剪接模式的变化有关。然而,科学家们还没有完全理解导致这种变化的过程。
为了更好地理解在癌症进展过程中选择性剪接变化的原因和后果,该团队观察了近900个前列腺组织样本的RNA序列,从健康的前列腺组织到局部或侵略性转移性肿瘤组织。为了有效地分析如此庞大的数据集,该团队创建了一个名为rMATS-turbo的新计算程序。通过这个程序,研究人员在900个前列腺样本中确定了超过13000个不同的剪接事件。
接下来,该团队开发了一种分析工具,称为PEGASAS(选择性剪接途径富集导向活性研究),以发现潜在的癌症驱动基因和与这些选择性剪接变化相关的途径。他们发现Myc基因与正常细胞功能有关,并且在许多癌症中被放大,它与癌症中选择性剪接变化有关基因它们自己调节选择性剪接。研究人员利用人类前列腺细胞来启动或关闭Myc活性,进一步证实这些剪接变化确实是由Myc驱动的。
然后,研究人员将同样的PEGASAS策略应用于乳腺癌和肺癌数据集,发现Myc活性和选择性剪接之间存在同样的关联,这表明Myc激活——从而剪接中断——在许多癌症中都发生。
PEGASAS在前列腺癌、乳腺癌和肺癌数据集上的成功应用表明,这种策略在分析途径驱动方面可能有用可变剪接在许多癌症类型中,”邢教授说。“考虑到在儿童癌症中涉及的致癌途径,如Myc途径,这些工具也可以揭示治疗儿童癌症的途径和目标。”
进一步探索












用户评论