肠道微生物重新编程肠道黏膜的遗传活性

来自德国癌症研究中心(German Cancer Research Center)和耶路撒冷希伯来大学(Hebrew University in Jerusalem)的科学家在小鼠身上证明,肠道细菌对肠道黏膜细胞中的DNA活动进行了重编程,因此对健康肠道的发育有相当大的影响。在实验条件下引起的急性肠道炎症导致微生物定植动物的粘膜细胞中炎症相关和促癌基因的活性大幅增加。
大量的研究工作表明,肠道微生物——换句话说,所有定居在人体肠道内的微生物——及其组成与一系列疾病有关。这些疾病包括肠道炎症和代谢紊乱,如肥胖症和糖尿病,以及癌症、孤独症和抑郁症。
这些研究通常只显示了它们之间的联系,而没有阐明它们之间的机制肠道微生物影响人体。德国癌症研究中心(DKFZ)的弗兰克·莱科(Frank Lyko)和耶路撒冷希伯来大学的耶胡迪·伯格曼(Yehudit Bergman)联手解决这个问题。
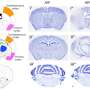
为了做到这一点,研究人员将具有正常微生物组的小鼠和在无菌条件下长大的小鼠的肠道黏膜细胞的DNA进行了比较。他们专注于分析DNA甲基化,即表观遗传标记,它阻止了DNA结合蛋白附着在这些位点的DNA上,从而限制了那里基因的活性。
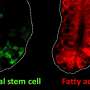
研究人员注意到无菌动物和微生物定居动物之间的甲基化模式有相当大的差异。在后者中,他们发现了一组被去甲基化激活的“哨兵基因”,这些基因负责健康肠道中肠粘膜的正常再生。
微生物定植的小鼠和无菌动物都用一种化学物质治疗,这种化学物质攻击肠道黏膜,从而诱发急性炎症。在微生物定植的动物中,这种处理导致了肠道黏膜细胞DNA甲基化的减少,特别是影响了一些调节元件。结果,许多在炎症和癌症中起作用的基因被激活。
相比之下,在没有微生物的小鼠中,这种化学物质几乎没有引起任何基因活动的变化。Frank Lyko解释说:“这表明甲基化的差异是由细菌造成的,而不是化学物质。”然而,如果微生物定植小鼠的微生物组转移到没有微生物的动物,这些小鼠的肠黏膜细胞的甲基化也会减少。
这个由德国和以色列研究人员组成的团队意识到,这种效果显然取决于去甲基化酶TET2和TET3:如果它们在基因上被关闭,用这种化学物质进行治疗几乎不会引起基因组甲基化的任何变化。
微生物组似乎对动物的健康有相当大的影响:它通过使用表观遗传编程来激活引导肠黏膜再生的基因,确保了肠道的正常发育。在无微生物老鼠然而,这种激活不会发生,”Frank Lyko解释道。“在急性炎症期间,肠道微生物也会引起基因活动的变化,而且基因在肠道炎症和结肠癌患者中也是如此。这再次强调了微生物在表观遗传调节中扮演的关键角色,”他补充道。
进一步探索













用户评论