机械工程师开发出更接近人体的肿瘤模型

在研究社区中,肿瘤环境的生物力学可能有助于其细胞生长,甚至扩散到全身的方式,这是越来越多的赞赏。研究人员在实验室中重新创造这些机械因素,他们就能更好地了解肿瘤细胞的迁移,以及如何在细胞入侵其他组织之前阻止它们。
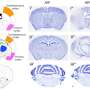
最近发表在Acta Biomaterialia伦斯勒理工学院(Rensselaer Polytechnic Institute)的一个机械工程师团队展示了一项新技术,该技术可以创造出一种体外生物模型来研究肿瘤,这种模型更复杂,因此也更接近肿瘤的本质癌症细胞可遇于身。
“迄今为止,我们已经比任何其他基于胶原蛋白的模型更接近胶原蛋白是如何在组织中组织的架构,”机械、航空航天和医学助理教授克里斯汀·米尔斯说核工程伦斯勒生物技术和跨学科研究中心的成员。
胶原蛋白是构成细胞外部结构的主要蛋白质,称为细胞外基质。因此,它也经常是用于生长的体外模型的主要成分肿瘤细胞在实验室里。
胶原蛋白为基础的细胞外基质模型的刚度很重要,因为正如米尔斯所见先前的研究,刚度的变化给出肿瘤有助于…的结构线索癌症进展。创建一个可以模拟可调刚度的模型是很重要的。
研究人员还发现,在体内,也就是在一个生物体内,胶原细胞外基质的结构在癌症的进展中起着作用。在肿瘤环境中,胶原蛋白形成纤维束,充当癌症的高速公路细胞移出肿瘤以便侵袭其他组织。米尔斯说,在它们形成的过程中,这些纤维束具有特定的大小和结构,这被认为使细胞更容易扩散。目前,这个过程还没有被完全理解,这就使得创建一个更接近这种结构的模型变得非常重要。
“我们注意到,这些纤维结构通常比实验室中创建的要大得多,所以我们的目标是创建更好的肿瘤相关模型细胞外基质龚翔宇说。他最近在伦斯勒米尔斯实验室(Mills Lab at Rensselaer)获得了机械工程博士学位,现在是耶鲁大学(Yale University)的博士后研究员。
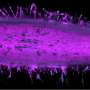
Rensselaer团队能够找到离子强度和温度的正确组合来诱导胶原——从组织中分离出来——形成微米级的束,而不是通常用于癌症研究的纳米级纤维凝胶。研究人员随后创造了一个微流体通道来排列这些束——就像它们在体内一样。
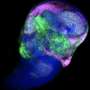
米尔斯说:“我们现在可以研究癌细胞是如何与胶原蛋白束相互作用的,研究的规模可以在体内看到。”“现在可以研究这个迁徙过程了。”
“我们发现这些侵略性癌细胞将遵循我们创建的这些高速公路,看起来与试图离开原始肿瘤部位的这些癌细胞的体内图像非常相似,”龚说。
这种新方法允许研究人员将他们新创造的胶原蛋白束与一种硬度可以调整的凝胶结合起来,以提供更精确和可控的模型它可以模拟体内组织的结构和与肿瘤交流的机械线索。
米尔斯和龚希望这项研究传达出一个更广泛的信息,即使用复杂和整体的模型来更紧密地模拟肿瘤细胞在体内遇到的系统状况的重要性。
进一步探索
















用户评论