细胞粘附分子调节突触形成和非快速眼动睡眠
有很多理论,但没有人确切知道我们为什么睡觉。有一件事我们可以肯定:不眠之夜不会帮助你度过一天。有很多研究探索了睡眠在大脑中是如何工作的,以及睡眠的目的是什么。然而,突触是如何与睡眠相关的,人们还知之甚少。韩国基础科学研究所(IBS, South Korea)突触脑功能障碍中心主任KIM Eunjoon领导的研究小组在体内发现,一种名为PTPδ的突触前细胞粘附分子对发育中的大脑突触的发育至关重要。因此,PTPδ的基因缺失导致受影响小鼠大脑结构、功能和生化组成的破坏,导致先天行为的改变,如过度运动活动、焦虑增加和睡眠减少。
人类大脑包含数十亿的神经元,它们通过突触相互交流。一个神经元通过突触前释放的神经递质向另一个神经元传递的信号被位于其他神经元突触后部位的神经递质受体所感知。反过来,神经元网络决定了大脑控制的所有行为和身体功能的表达。所有这些大脑功能的综合网络的核心是突触细胞粘附分子(CAMs)。CAMs通过连接突触前和突触后侧来调节突触的发育。为了保证神经元回路和大脑功能的正常发育,在幼年神经元的发育过程中,在众多不同种类的突触前和突触后cam中进行适当的配对是至关重要的。
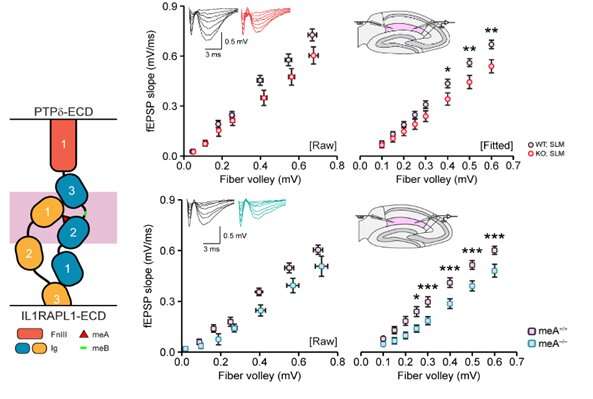
研究团队专注于寻找PTPδ的特定作用,因为它仅被怀疑在突触形成中起关键作用。他们开发了一种荧光分子标记的PTPδ,其在大脑中的表达允许精确和清晰地可视化PTPδ在整个大脑中的自然位置,并精确到突触内的位置,达到纳米级精度。他们还采用了PTPδ的条件缺失来确定突触形成的关键关节成分。至关重要的是,该团队已经证明,突触前PTPδ与其突触后结合伙伴IL1RAPL1相互作用的中断导致先天行为的所有关键变化,如图2和3所示。
-
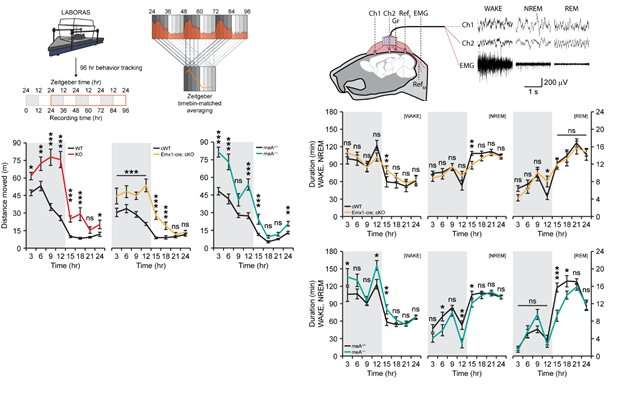
图2。PTPδ在小鼠中缺失导致过度活动和减少非快速眼动睡眠。左侧的图表显示PTPδ全缺失(红色)、PTPδ-兴奋性神经元缺失(黄色)和PTPδ- mea缺失(海蓝宝石)小鼠与对照组(黑色)相比在整个24小时内的过度活跃。右边的图表显示了在ptp δ-兴奋性神经元缺失(黄色)和PTPδ-meA缺失(海蓝宝石)小鼠中,非快速眼动睡眠减少,以δ波表示深度睡眠。来源:基础科学研究所 -
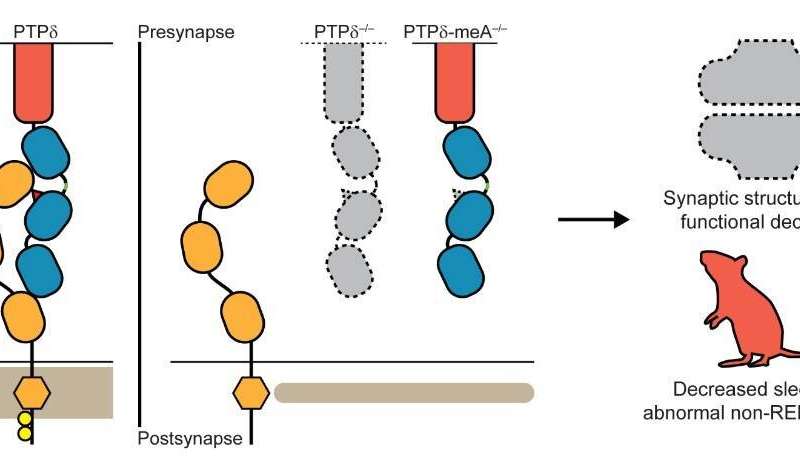
图3.描绘了研究的关键结果的原理图。在突触中突触前PTPδ和突触后IL1-RAPL1的左,正常突触相互作用,其重视PTPδ(红色三角形)中的MEA。在中间,通过损失整个PTPδ或MEA的破坏反式突触PTPδ-IL1P1的破坏。在右侧,缺失突触PTPδ-IL1PL1相互作用的损失导致突触结构的丧失,并且功能随着睡眠和异常睡眠节律而表现出的改变的脑函数,如在非REM深度睡眠期间在DELTA波中所见。来源:基础科学研究所
先前已经表明,跨突触相互作用(从一个神经元到下一个神经元跨越突出的相互作用)取决于PTPδ蛋白内的六个氨基酸长短肽序列(称为MEA)。研究团队使用这些知识来专门阻止PTPδ-IL1APL1相互作用。当删除关键的MEA序列时,将其余的PTPδ功能且完整地,IL1APL1不能绑定到PTPδ,因此无法保持在突触的突触侧。这导致大脑穿过突触的数量的显着降低,扰乱了形成和确定诸如睡眠的行为输出的复杂神经元电路。他们还在兴奋性神经元中选择性地删除了PTPδ,并确认了突触行为中断的假设,确实局限于兴奋性神经元。
该研究团队还表明,当IL1RAPL1不能通过突触与PTPδ结合时,IL1RAPL1自身的化学成分发生变化,其氨基酸序列中被称为酪氨酸磷酸化的过程被几乎完全阻断。IL1RAPL1固有特性的这种变化伴随着IL1RAPL1从突触中被排除。因为IL1RAPL1对突触的成熟至关重要,这种排斥导致突触的结构和功能下降。在ptp δ-突变小鼠中,大脑在这种基本水平上的破坏会导致焦虑的增加和睡眠的减少。
有几项研究将突触CAMs与小鼠异常行为联系起来。值得注意的是,这项研究首次全面概述了CAMs与睡眠(一种基本的大脑功能)之间的联系。此外,之前没有研究将突触前和突触后特定的一对CAMs与睡眠或睡眠或与睡眠相关的行为(如多动和焦虑)联系起来。由于PTPδ编码基因的突变与许多精神疾病有关,比如精神分裂症,注意缺陷多动障碍多动症(ADHD)和不宁腿综合征(一种睡眠障碍),每一种疾病影响1%到5%的人一般人群在世界范围内,这项研究阐明了PTPδ的变化如何可能导致与上述疾病类似的症状。
胚胎和早期后阶段的大脑的发展对于适当表达行为和脑相关功能至关重要。本研究表明,即使是PTPδ-IL1PL1相互作用的奇异破坏,在许多可能对和后突前凸轮中也具有后果,使生物的整个寿命(例如永久性睡眠)。鉴于睡眠对生存至关重要,在康唐在康唐在一个结合对的中断可能会谈到这一发现的重要性,这将进一步了解如何理解基本构建块大脑影响复杂的行为,如睡眠。
进一步探索







用户评论