NIH临床试验检验RemdesiviR加上Covid-19的抗炎药物金龟子
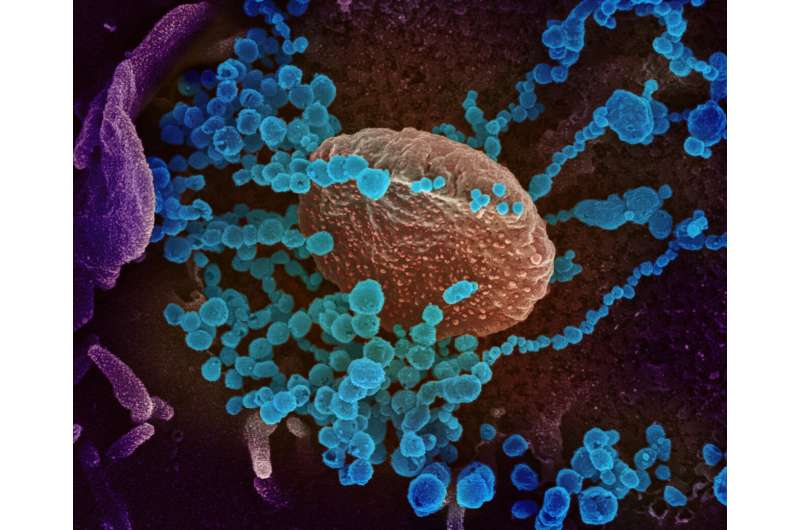
对研究抗病毒雷达尔治疗方案的随机对照临床试验评估了调查抗病毒雷达尔患者对冠状病毒疾病(Covid-19)的抗炎药物疾病的安全性和有效性。该试验现正与美国的Covid-19注册住院成人。预计该试验将在大约100美元和国际网站开放。目前预计招收超过1,000名参与者的调查人员。国家过敏和传染病研究所(NIAID),部分国家卫生研究院,正在赞助审判。
临床试验是NIAID的下一次迭代自适应Covid-19治疗试验(Actt)从2月21日开始评估Remdesivir,这是由Gilead Sciences,Inc。开发的调查广谱抗病毒治疗,该审判在4月19日招聘了47美元和21个国际网站的1,063名参与者之后才能入学。监督审判的独立数据和安全监测委员会(DSMB)于4月27日举行会议,并与研究赞助商NIAID分享了初步分析。他们的分析表明接受RemdesiviR的患者与接受安慰剂的患者相比,恢复统计上显着较短的时间。将在即将发布的报告中提供有关试用结果的更详细信息,包括更全面的数据。在与BaricitInib的下一次试验中,称为Actt 2,所有参与者将获得Remdesivir或Remdesivir与Baricitinib。
"We now have solid data showing that remdesivir diminishes to a modest degree the time to recovery for people hospitalized with COVID-19," said NIAID Director Anthony S. Fauci, M.D. "ACTT 2 will examine if adding an anti-inflammatory agent to the remdesivir regimen can provide additional benefit for patients, including improving mortality outcomes."
Baricitinib.,由Chilyte和公司在品牌名称olemiant上销售的产品许可的产品,在美国,在美国批准,超过65个额外的国家,作为成年人的治疗,以严重活跃的类风湿性关节炎。有些人有Covid-19体验急性呼吸窘迫综合征(ARDS),肺部的炎症导致呼吸急促和快速呼吸。白藜芦醇,口服,抑制在体内的细胞因子信号传播,这在引起炎症反应的作用中起作用。在从Covid-19恢复的批评患者的案例系列中描述了Covid-19的Baricitinib的推定效益。Remdesivir和CovidInib的组合尚未在大型随机对照治疗试验中进行评估。
根据标准的临床研究协议,提供知情同意的符合条件的患者将参加Actt 2.审判的参与者必须有实验室证实的SARS-COV-2感染和肺部参与证据,包括需要补充氧气,胸部异常X射线或需要机械通气的疾病。具有轻度症状或没有明显症状的确诊感染的个体不会包括在研究中。符合条件的学习参与者将随机分配1:1至治疗部件:
ARM 1:参与者在口服和静脉内(IV)雷米德雷马尔马尔2:参与者在口头和IV Remdesivir接受安慰剂
该研究是双盲的,意思是审判调查人员和参与者都没有知道谁正在接受哪些治疗方案。RemdesiviR作为一种200毫克(Mg)IV剂量给药,然后进行100mg一次每日IV剂量,用于住院期间的持续时间为10天的治疗过程。为4毫克口服剂量(或通过鼻胃管(如有必要)给予4毫克口服剂量(或通过鼻胃管给药)在住院期间的持续时间持续至14天的疗程。安慰剂片同样是白糖蛋白,但仅含有非活性成分。
调查人员将评估组合ARM(Bariticinib Plus Remdesivir)的恢复是否较短,相对于雷德梅尔独自的。恢复被定义为参与者足以用于医院放电,这意味着参与者还不再需要在医院内需要补充氧气或正在进行的医疗保健,或者不再住院(有或没有某些活动限制)。评估恢复到第29天。该研究的关键二级目标是使用从完全恢复到死亡的序数八点尺度在第15天比较患者结果。该试验还将比较治疗组之间的其他次要结果变量,仅包括死亡率。
独立数据和安全监测委员会(DSMB)将监控正在进行的结果,以确保患者健康和安全以及研究完整性。












用户评论