蛋白质形状在阿尔茨海默氏症的研究中很重要
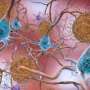
有时候错误折叠的蛋白质。当这种情况发生在人类大脑时,错误折叠的蛋白质堆积可能导致阿尔茨海默氏症、帕金森症和ALS等神经退行性疾病。
蛋白质不会突然行为异常或折叠错误。生物化学的相互作用和环境构成了一个微妙的生态系统,通常让它们扭动、展开、折叠并按照它们的计划完成它们的工作。
然而,密歇根理工大学的研究人员在一篇发表于ACS的化学神经科学在美国,即使是很小的变化也可能造成长期的后果。
为β淀粉样蛋白肽这被认为是阿尔茨海默氏症的主要特征蝴蝶效应导致蛋白质错误折叠,聚集和细胞毒性。
乙酰化和淀粉样蛋白毒性
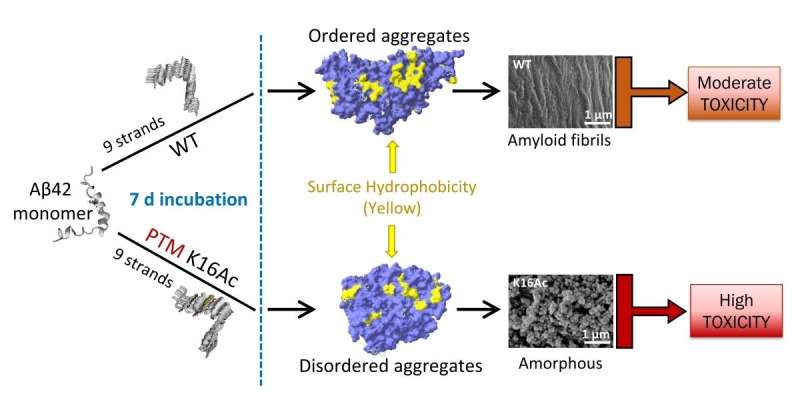
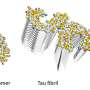
密歇根理工大学的化学副教授阿舒托什·蒂瓦里解释说,错误折叠的β淀粉样蛋白往往会堆积并形成聚集体,从而形成纤维状原纤维或球状的无定型形状。
为了理解是什么导致了不同的形状为了评估它们的毒性,蒂瓦里的团队研究了乙酰化作用。
乙酰化是蛋白质最常见的化学修饰之一,但它是如何影响淀粉样蛋白毒性的研究最少的一个。淀粉样β蛋白的乙酰化可发生在两个位点:赖氨酸16和赖氨酸28。

研究小组发现赖氨酸16的乙酰化导致无序聚集,形成粘性但灵活的无定形结构,并显示出高度的毒性。他们还发现,聚集物显示出更高的自由基形成。
蒂瓦里说:“没有人做过系统的研究表明,如果你乙酰化淀粉样蛋白,它会改变聚集体的外观,然后它的生物物理特性会改变,因此毒性也会改变。”“我们要说的是,聚集蛋白结构的形状、粘性和灵活性在细胞毒性中发挥了重要作用,也可能影响毒性机制。”
骨料和阿尔茨海默氏症
在阿尔茨海默症中,这些聚集物会在大脑中影响记忆的部分聚集。据阿尔茨海默氏症组织(Alzheimer's Organization)报告,这种疾病是美国第六大死亡原因,到2020年,美国将损失约3050亿美元。蒂瓦里说,关于这种疾病,我们真正需要了解的是,没有单一的病因,没有单一的触发因素,由于涉及的化学物质,可能也没有灵丹妙药。
Tiwari说:“这就是单个位置的细微变化如何影响整个蛋白质的聚集。”他补充说,乙酰化对另一种蛋白质聚集的影响,比淀粉样蛋白的研究要多得多。此外,许多研究人员仍然认为,一个错误折叠的蛋白质必须看起来有某种特定的方式才会有问题,而其他错误折叠的形式就不是什么问题了。
蒂瓦里同意一些蛋白质的变化是微妙的,并比较了辨别差异及其对雪地轮胎的影响。雪地轮胎的胎面更深,在冬季路面上使用的材料也更灵活,但在高速公路上很难指出这些特点。就像不同种类的轮胎一样,蛋白质的形状从远处看很难分辨。
蒂瓦里说:“这不是一个可以从远处观看的东西,它是一个触摸和感觉的财产。”“我们必须探究这些属性。我们必须从形态学和生物物理学的角度更深入地研究这些结构。”
当我们这样做的时候,我们可以更好地理解错误折叠蛋白质的复杂性淀粉样蛋白β毒性会导致神经退行性疾病像阿尔茨海默氏症。
进一步探索











用户评论