研究发现寻址阿尔茨海默血脑屏障障碍的路径
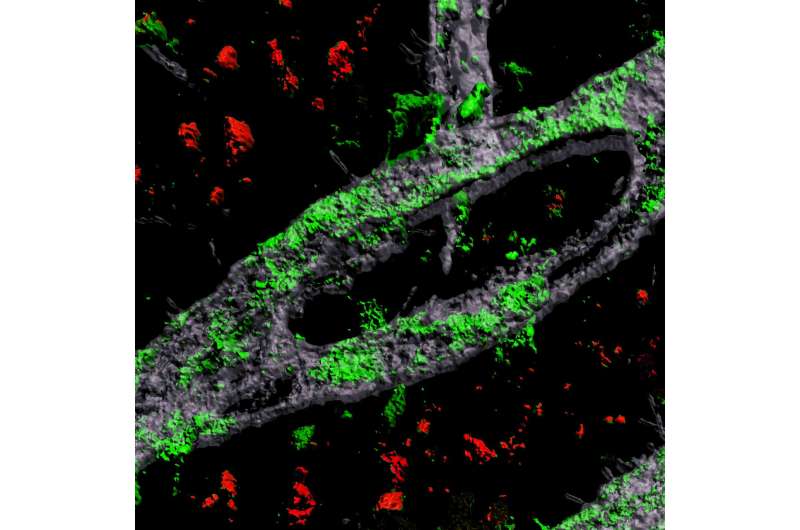
通过开发人类血脑屏障(BBB)的实验室工程模型,MIT的Picower学习和记忆研究所的神经科学家发现了最常见的阿尔茨海默病风险基因导致淀粉样蛋白斑块破坏大脑的血管系统并显示它们防止已经批准用于人类使用的药物的损伤。
大约25%的人携带APOE基因的APOE4变体,这使他们患阿尔茨海默病的风险大大增加。几乎所有患有阿尔茨海默氏症的人,甚至一些没有这种病的老年人,都会受到折磨脑淀粉样血管病变(CAA),一种条件淀粉片血管壁上的蛋白质沉积物损害了BBB适当运输营养,清除废物并防止侵袭病原体和不需要物质的能力。
在新的研究中,6月8日发布自然医学,研究人员针对特定的血管细胞型(周细胞)和分子途径(钙皮泌菌素/ NFAT)进行了精确的,通过该分子途径(Calcineurin / NFAT)促进CAA病理学。
皮考尔神经科学教授兼皮考尔研究所所长、资深作者li - hui Tsai解释说,研究表明,携带APOE4变体的人,血管中的周细胞会产生过多的APOE蛋白。载脂蛋白e导致淀粉样蛋白聚集在一起,而淀粉样蛋白在阿尔茨海默氏症中更为丰富。同时,病变周细胞calcineurin/NFAT分子途径的激活增加似乎促进了APOE表达的升高。
已经有毒抑制了途径。目前他们用于在移植后延长免疫系统。当研究人员向一些药物施用一些药物,包括环孢菌素A和FK506,用APOE4变体累积,它们比未处理的淀粉样蛋白累积得多。
Tsai实验室的博士后、该研究的第一作者Joel Blanchard说:“我们发现,在易患阿尔茨海默病的人群中,有一种特定的基因通路表达不同。”“通过识别这一点,我们可以识别药物,改变这一途径回到非疾病状态,并纠正与阿尔茨海默氏症相关的结果。”
建立障碍
为了研究阿尔茨海默病、APOE4变异和CAA之间的联系,布兰查德、蔡和合著者诱导性诱导了人类多能干细胞成为构成BBB的三种细胞:脑内皮细胞,星形胶质细胞和周细胞。细胞被镜像细胞进行模拟,它们可以广泛测试,以确保它们表现出不同的特性和基因表达。
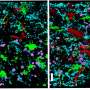
在三维水凝胶支架中生长了两周,BBB模型细胞组装成具有天然BBB性质的容器,包括对分子的低渗透性和与天然BBBS相同的关键基因,蛋白质和分子泵的表达。当浸入蛋白蛋白蛋白蛋白培养基中的培养基中,模拟阿尔茨海默氏病大脑的条件,实验室生长的BBB模型在人类疾病中表现出相同种类的淀粉样蛋白积累。
通过建立模型BBB,然后他们试图测试差异apoe4。它们显示出几种措施,即携带的Apoe4载体模型与培养介质的淀粉样蛋白累积比携带的apoe3,更典型和健康的变体累积。
要确定apoe4如何实现差异,他们设计了八种不同的版本,涵盖了具有apoe3或apoe4的三个单元格类型的所有可能组合。将这些月级模型暴露于含淀粉样蛋白培养基时,仅具有ApoE4细胞样壁细胞的版本显示出淀粉样蛋白的过度积累。用apoE3携带的apoe4壁细胞减少淀粉样蛋白沉积。这些结果对CAA样病理正称归咎于周围的病理。
为了进一步验证这些发现的临床相关性,该团队还研究了前额叶皮质和海马的人脑血管系统样本中的ApoE表达,两个地区在阿尔茨海默病患中至关重要。与团队的实验室BBB模型一致,APOE4的人们表现出血管系统中基因的更高表达,并且特别是在综合症中,比Apoe3的人。
“这是本文的突出观点,”麻省理工学院老龄化脑倡议的创始成员Tsai说。“它真的很酷,因为它强调了apoe的细胞类型特定功能。”
对待治疗的途径?
下一步是确定apoE4如何由周刊变得如此过表达。因此,该团队确定了数百种转录因子 - 蛋白质,其确定如何表达基因 - 这在apoE3和apoe4周上镜像细胞之间不同的调节。然后他们彻底挑选了该列表,以查看哪些因素特别影响apoe表达。在ApoE4细胞上上调的一系列因素突出:是钙素/ NFAT途径的一部分的因素。他们观察到人类海马样品的围绕途径的类似上调。
作为该通路信号活性升高是否导致淀粉样蛋白沉积和CAA增加的调查的一部分,他们测试了环孢素A和FK506,因为它们抑制了通路活性。他们发现药物降低了APOE在周细胞样壁中的表达细胞因此在血脑屏障模型中apoe4介导的淀粉样蛋白沉积。他们还在携带apoe4的老鼠身上测试了药物,发现药物减少了APOE的表达和淀粉样蛋白的积累。
Blanchard和Tsai指出,药物可以具有显着的副作用,因此他们的发现可能无法建议使用那些药物来解决患者的CAA。
“相反,它指向了解机制的价值,”布兰安德说。“它允许人们设计一个小分子屏幕,以找到更多有效的药物,这些药物具有较少的目标效果。”
进一步探索










用户评论