针对参与自身免疫性眼病的分子发现的双重作用
根据国家眼睛研究所(NEI)研究人员的一项研究,炎症分子白介素17a(IL-17A)触发了免疫细胞,从而降低了IL-17A的促炎活性。在眼睛和大脑的自身免疫性疾病模型中,阻塞IL-17A增加了Th17细胞产生的其他炎症分子的存在,Th17细胞,产生IL-17A并参与神经炎症的免疫细胞。这一发现可以解释为什么针对眼部疾病自身免疫性葡萄膜炎和多发性硬化症(MS)等疾病等疾病的治疗方法失败了。有关调查结果的报告已在免疫。NEI是美国国立卫生研究院的一部分。
在自身免疫性葡萄膜炎中,免疫细胞变得异常激活并开始摧毁健康细胞,包括光感受感受器和神经元。参与该反应的关键免疫细胞是Th17淋巴细胞,该淋巴细胞产生几种称为细胞因子的促炎分子。Th17细胞的标志是产生IL-17A的能力,吸引了免疫细胞称为嗜中性粒细胞,会损害组织。然而,对IL-17A阻滞的药物进行的多项临床试验未能帮助患有自身免疫性葡萄膜炎或MS的人。
“ IL-17是原型的炎症免疫分子,指责为神经 - 雷蒂纳和大脑的自身免疫性,但关于它所扮演的角色存在争议,” Rachel Caspi博士说,”在免疫学实验室主任Rachel Caspi博士说NEI和该研究的高级作者。“在我们的自身免疫性葡萄膜炎模型中,我们注意到,如果没有IL-17,组织损伤的量意外保持不变,并且我们的其他炎症分子水平较高。”
Caspi及其同事使用小鼠模型研究IL-17A在疾病过程中的功能。研究人员能够从Th17细胞中有选择地去除IL-17A,并检查葡萄膜炎和MS模型中细胞的行为。奇怪的是,他们发现这些细胞产生更多的IL-17F,GM-CSF,甚至可能其他炎症性分子。研究人员得出的结论是,这些额外的炎症细胞因子弥补了驱动炎症时IL-17A的损失。
卡斯皮说:“这项工作怎么办,我们问自己。”“科学家就像小孩一样,当他们得到一个问题的答案时,立即有'为什么?'的下一个级别。因此,我们开始研究使整个事情都打扰的更深层次的机制。”
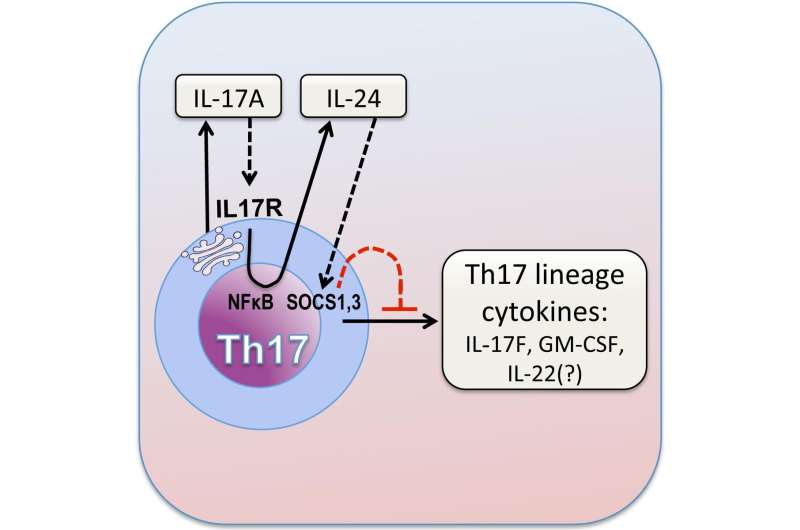
通常,IL-17A信号被其他细胞(包括视网膜组织细胞和中性粒细胞)拾取,该细胞携带IL-17受体。该受体是一种细胞表面蛋白细胞,与锁和钥匙一样与IL-17A拟合。但是在这种情况下,研究人员首先在Th17细胞的表面上发现了IL-17受体的副本,该副本首先使IL-17A成为IL-17A。
Caspi说:“已知有时会在其他细胞类型中发生的自身产生的信号的细胞过程(称为自分泌信号传导)。
Caspi及其同事发现,当IL-17A与Th17细胞上的受体结合时,这会触发一个信号传导级联,该级联变为细胞的产生抗炎分子Interleukin-24(IL-24),以前尚不清楚。由Th17细胞产生。IL-24反过来抑制了Th17细胞的其余炎症程序,拒绝了IL-17F,GM-CSF和可能的IL-22等细胞因子的产生。因此,没有IL-17A,就不会发生这种自分泌环,从而导致Th17细胞产生其他炎症细胞因子,从而增加炎症。
IL-17a与几种类型的葡萄膜炎有关,这种疾病在美国葡萄膜炎中最多可导致15%的失明病例,通常用类固醇治疗,可能具有严重的副作用。
卡斯皮说:“有些疾病,例如牛皮癣,抗IL-17A疗法取得了惊人的成功。我们希望这也适用于葡萄膜炎,但事实并非如此。”“这项研究可能解释了为什么针对IL-17A治疗葡萄膜炎的临床试验没有成功,并表明涉及IL-17A和IL-24的组合方法可能在治疗神经系统的自身免疫性疾病方面更有效。”
进一步探索










用户评论