由rna靶向化合物促进的心脏修复因子

心脏病发作可能会使心脏部分留下永久性的疤痕和僵硬,导致长期残疾,并可能发展为心力衰竭。科学家们已经研究了各种修复或再生受损心脏组织的方法,但成效有限。
Scripps Research Chemist Matthew Disney,Ph.D的新学习表明,通过针对失败飙升的必需生物分子心肌肉,也许有一天可以用药物治愈受损的心脏组织。
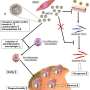
该杂志周一发表了一项研究自然化学该研究报告称,他们首次发现了一种化合物,能够在细胞模型中重新启动血管内皮生长因子a (VEGF-A,血管内皮生长因子a的简称)的细胞生成。多年来的研究表明,VEGF-A作为干细胞的信号,使它们在受损的心脏组织中重建血管和肌肉,并改善血液流动。
靶向rna——基因和蛋白质生产之间的“中间人”——在逻辑上是有道理的,但用药物这样做曾经被认为是不可行的。长期以来,rna因其简单的四碱基结构和动态形状而被认为是小分子药物靶点。多年来,迪士尼和同事们开发了一系列计算和化学工具,旨在克服这些障碍。
“在一个心脏病,这种损伤会导致促进新的健康血管生长的蛋白质停止生长,”迪斯尼解释说。“我们分析了蛋白质如何被沉默的整个途径,然后我们利用这些信息来确定如何重新激活它的表达。”
第一作者Hafeez Haniff, a研究生佛罗里达斯克里普斯研究中心(Scripps Research)与阿斯利康(AstraZeneca)的科学家合作,分析了VEGF-A产生的基因组学基础,以评估最佳RNA药物靶标。该团队选择了一种名为pre-miR-377的microRNA前体,发现它在衰竭的心肌中扮演了生成VEGF-A的调光开关的角色。
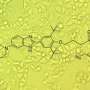
然后,他们使用迪士尼的计算和化学工具,结合来自阿斯利康的一系列化合物,寻找能够选择性地结合pre-miR-377关键保守结构特征的化学伙伴。
哈尼夫解释说:“通过将活性化合物与其他辅助分子结合,实现了显著的靶向特异性。”
其他已尝试的促进VEGF-A产生的策略包括使用VEGF-A本身,或传递编码该蛋白质的信使RNA。
“与潜在的特异性、结合rna的小分子先导药物相比,这些方法中的每一种都使用了大型化合物,但它们在病变组织中的分布有限,”Disney说。
到目前为止,这种化合物已经在细胞中进行了测试,而不是在整个动物模型中心脏衰竭,迪斯尼笔记。
“我们提供了一个领先的小分子化合物来重新编程细胞的软件,迫使它重新表达VEGF-A,”迪斯尼说。“将TGP-377转化为一种有潜力的药物并送达患者需要相当多的时间和研究。”
迪士尼称他们的成功是一个“测试案例”,这表明可靠和可预测地开发用于预先定义的RNA目标的药物化合物和诱导细胞模型中的蛋白质生产是可能的。
阿斯利康的Malin Lemurell称这是潜在的重要的第一步。
“设计能够与RNA相互作用和调节的小分子的能力,可以为靶向挑战性疾病途径开辟新的途径,这些疾病途径以前被认为是不可用药的,”药物化学、研究和早期发展、心血管、肾脏和代谢主任Lemurell说。阿斯利康的生物制药研发。“这项研究使得质量工具的生成成为可能化合物这将有助于进一步探讨这种行动模式。”
迪斯尼说,由于对TGP-377进行了大规模的筛选,该小组将已知的rna结合小分子的数据集扩大了20倍,这对多种不可治愈的疾病都有影响。
“几乎所有疾病都有潜在的RNA药物靶点。”迪斯尼说道。“我们现在有一个更强大的工具箱来寻找具有药用潜力的先导分子。”
进一步探索















用户评论