免疫治疗可延长难治性乳腺癌小鼠模型的生存期
用于癌症治疗的免疫治疗,使免疫系统攻击肿瘤 - 是抗癌阿森纳中的有价值的武器。但是,一些癌症比其他策略更难以定位。今天,科学家们报告了一种新型免疫疗法,可显着延伸具有三重阴性乳腺肿瘤的小鼠的存活,这是一种难以治疗的癌症形式。
研究人员将在美国化学学会(ACS)下降2020年的虚拟会议和世博会上呈现他们的结果。
“从免疫疗法的角度来看,三重阴性的最大问题之一胸部癌症的关键在于它不产生任何已知的抗原,或被人类识别的分子免疫系统卡桑德拉·卡尔曼博士(Cassandra Callmann)说。“如果你没有已知的肿瘤特异性抗原,就很难训练你的免疫系统在无视肿瘤的同时追逐肿瘤。健康的细胞”。
根据三重阴性乳腺癌基础,该疾病占所有乳腺癌的15-20%。肿瘤从它的雌激素受体,孕酮受体和过量的HER2蛋白 - 三种蛋白质的事实中获得了雌激素受体,通常由其他类型的乳腺癌产生的蛋白质。因为三重阴性乳腺癌缺乏这些标志,所以许多常用的乳腺癌药物都没有有效。根据美国癌症社会的说法,这是三重阴性乳腺癌的预后比其他形式的原因是一个原因。
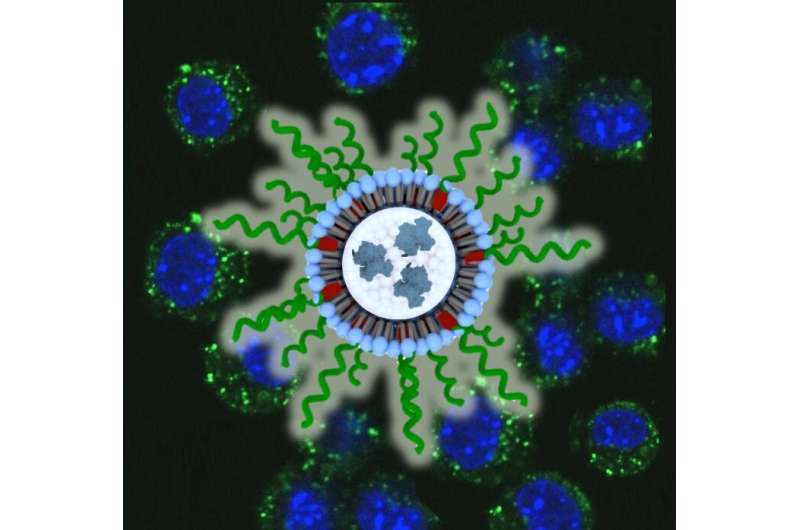
Callmann是西北大学Chad Mirkin博士实验室的博士后研究员,为了开发一种新的治疗方法,他需要采用一种不同于传统的针对肿瘤特异性抗原的免疫疗法。“当时的想法是切除肿瘤细胞Callmann说:“我们会把它们切碎,喂给免疫系统,然后让免疫系统自己弄清楚要对付什么。”其他研究人员也曾尝试过这种方法治疗不同的癌症,但他们通常将切碎的肿瘤细胞(称为裂解液)和一种刺激免疫系统的分子(称为佐剂)作为混合物使用。相反,该团队将裂解液和佐剂打包在一个单一的纳米颗粒中。这种被称为球形核酸(SNA)的纳米颗粒在其核心包含裂解液,以及从其脂膜壳放射出的DNA佐剂的许多副本。
当研究小组将SNAs注射到小鼠皮肤下时,SNAs会转移到淋巴结。在那里,sna进入细胞,释放它们的物质,刺激细胞对裂解液中的抗原产生免疫反应。有趣的是,一个更强大的免疫反应当研究人员掺入氧化的肿瘤细胞裂解物时,粘附肿瘤细胞进入snas。
研究人员测试了对小鼠植入小鼠三重阴性乳腺癌肿瘤的治疗。三分之二的小鼠接受氧化裂解物的SNAS经历完整瘤缓解期至少90天,而所有未经治疗的动物都在30天死亡。所有治疗小鼠都没有明显的副作用或自身免疫反应。
Callmann说,这种疗法还没有准备好进行临床试验。接下来的步骤之一将是调查为什么氧化的裂解物比常规的裂解物工作得更好。研究小组已经开始识别比其他裂解液更具免疫原性的裂解液亚群。她指出,受到压力的细胞可能会产生不同的蛋白质,或者氧化剂正在改变蛋白质上的化学基团。为了获得更清晰的图像,Callmann计划进行蛋白质组学分析,以确定氧化和非氧化裂解物之间的蛋白质差异。
氧化裂解物/ SNA方法也可以证明对于治疗其他肿瘤也是有用的。“我们已经证明了一个整体结构呈现癌症疫苗或免疫治疗性,而不是仅仅是活性化学成分的身份,决定了其效力,并且该发现在该领域的门打开,“Mirkin说。
进一步探索
摘要
在此,我们描述了纳米级疫苗对三重阴性乳腺癌(TNBC)的合成和发育,其使用携带寡核苷酸的Toll样受体9(TLR9)激动剂作为其壳体上的佐剂并含有肿瘤细胞裂解物的球形核酸(SNAs)。抗原在核心。这些裂解物加载的SNAS表明了高封装效率,快速摄取和相对于辅助和抗原的简单混合物的免疫刺激增强。此外,在掺入疫苗之前,裂解物的氧化显着增强了它们作为抗原的效力,导致体外和体内均匀差异。在TNBC的异种移植物小鼠模型中,封装氧化裂解物的SNAS显示出显着的抗肿瘤功效,并且相对于用非氧化裂解物制备的SNA和具有佐剂DNA的简单氧化裂解物的简单混合物,显着延伸了整体存活。这项工作为生物材料设计为癌症疫苗提供了关键洞察力;即,将裂解物掺入纳米材料的情况下,改善了整体疫苗功能,以及抗原的制备如何影响其观察到的免疫原性。















用户评论