新型冠状病毒抗体临床试验开始

芝加哥大学医学院正在启动一项临床试验,研究一种抗SARS-CoV-2刺突蛋白抗体治疗COVID-19的潜力。COVID-19是由新型冠状病毒引起的疾病。
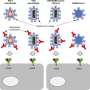
在BLAZE-1试验中,芝加哥大学招募了22名参与者,接受礼来公司与AbCellera合作开发的LY-CoV555抗体治疗。美国国家过敏和传染病研究所和AbCellera的科学家首次在一名从COVID-19康复的美国患者的血液样本中发现了这种抗体。
这种中和性单克隆抗体针对SARS-CoV-2病毒表面的刺突蛋白并与之结合,阻止其附着并进入人体细胞。没有细胞,病毒就无法复制。
“有数据表明,LY-CoV555抗体可以在实验室中阻止病毒在细胞中复制,”芝加哥大学医学院传染病和全球健康科主任大卫·皮特拉克医学博士说。“现在我们正在进行人类研究看看用这种抗体治疗患者是否会降低他们的病毒载量,这与更好的临床结果有关,也可能会降低患者对病毒的传染性。”
LY-CoV555的安全性最初在2020年6月开始的一期临床试验中进行了评估。这项二期试验将扩大LY-CoV555的安全性测试,并将研究该抗体在降低轻至中度COVID-19患者的病毒载量、临床症状和感染体征方面的影响。在芝加哥大学医学院,这项研究是传染病和全球卫生与急诊医学部门之间的合作。
“现在,我们正在测试单剂量抗体的效果,”Pitrak说。“当一名患者带着相容的症状进入急诊室,并被诊断患有COVID-19,但病情还没有严重到需要入院治疗时,我们可以询问他们是否愿意参加这项研究。在他们被送回家之前,他们会在急诊室被注射抗体或安慰剂。”
为了符合BLAZE-1研究的资格,参与者必须在研究药物注射前三天内对SARS-CoV-2感染检测呈阳性,并且有一种或多种轻度或中度COVID-19症状,包括发烧、咳嗽、喉咙痛、头痛、肌肉疼痛、恶心、腹痛、腹泻或活动时气短。
研究人员将对患者进行长达90天的跟踪,测试三种不同剂量的抗体,监测任何副作用,并测量呼吸道中的病毒载量和血液中抗体的水平。这些措施将有助于确定抗体治疗病毒的有效性,以及它在感染后能为患者提供多长时间的保护。
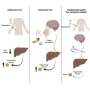
这项研究通过给予恢复期血浆来治疗COVID-19,代表了一种被动免疫的替代方法。从病毒中恢复的患者已经开始传播抗体在血液中不同程度地抵抗SARS-CoV-2病毒;这些康复患者的血浆输血可以增强患者的免疫系统,为他们对抗感染提供额外的支持。康复后,这些患者会保留这些抗体,为再次感染提供一些保护。然而,在这个阶段,恢复期血浆对病毒的中和能力尚不清楚。
LY-CoV555的鉴定和生产允许大规模生产一种针对并阻止SARS-CoV-2刺突蛋白感染细胞的特异性抗体。这规避了血浆可用性和生物相容性问题等挑战,并提供了一种更彻底地中和病毒的治疗方法。
皮特拉克说:“虽然这种特定的中和抗体是新的,但它并不是没有先例。”“疾病特异性单克隆抗体疗法已经用于临床治疗艾滋病毒,以及呼吸道合胞体患儿病毒以及复发性艰难梭菌感染的患者。”
总体而言,该研究旨在于2020年8月底前在多个医疗中心招募400名患者。如果这种抗体有效,它将为治疗COVID-19患者提供新的机会,特别是那些免疫系统受损的患者,他们可能不是未来疫苗的良好候选者。
礼来制药公司首席科学官Daniel Skovronsky医学博士说:“与包括芝加哥大学医学院在内的全国各地的研究机构启动BLAZE-1研究,是全球抗击COVID-19的一个巨大里程碑,我们很高兴能让行业更接近潜在的治疗方法。”“我们期待与符合条件的患者合作,他们不仅有兴趣接受COVID-19的研究性治疗,而且还了解他们的参与将如何影响世界各地数百万人的健康和福祉。”
进一步探索