癌症研究人员合作,靶向癌症治疗的DNA损伤修复途径
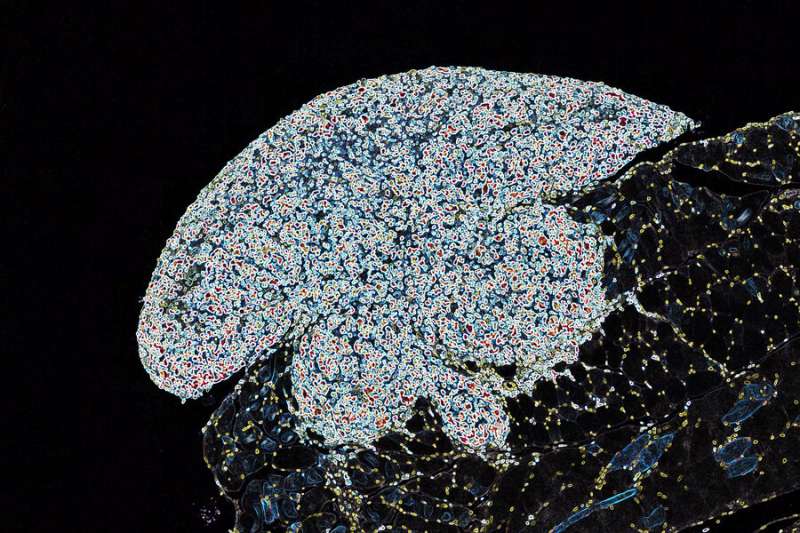
目前靶向肿瘤细胞突变引起的特异性分子缺陷的癌症疗法目前是抗癌药物发展的重点。然而,由于缺乏良好的目标和肿瘤的遗传变异,基于铂的化学疗法仍然是治疗许多癌症的主干,包括具有肿瘤抑制基因P53的突变版本的那些。P53在大多数癌症中突变,这使得肿瘤细胞能够产生对基于铂的化学疗法的抗性。但是,这些缺陷仍然可以通过靶向第二基因来捕获肿瘤细胞来选择性地靶向靶向肿瘤细胞,从而利用称为合成致死率的现象。
专注于理解和靶向癌细胞信号,迈克尔·亚菲的实验室,大卫··科赫(David H. Koch)科学和麻省理工学院精密癌症医学中心主任,寻求识别彼此合成致命的途径,并开发治疗利用这种关系的策略。他的小组已经将MK2鉴定为癌症中的关键信号传导途径和合成致死组合的P53伴侣。
现在,亚菲的实验室与麻省理工学院科赫综合癌症研究所的一组研究人员合作,为这种组合添加了一个新目标,基因XPA。出现在自然通讯此后,作品表明了“增强合成致死率”的潜力,其中第三基因产物的耗尽增强了已知的靶标的靶标的组合。他们的作品不仅展示了组织癌症目标的有效性,还可以是Koch Institute所称的合作团队。
P53服务了两个功能:首先,给予细胞通过暂停细胞分裂修复DNA损伤的时间,第二,如果DNA损伤过于严重,则诱导细胞死亡。基于铂化化疗通过诱导足够的DNA损伤来启动细胞的自毁机制。在他们以前的工作中,Yaffe实验室发现,当癌细胞丢失P53时,它们可以将其信号电路重新连接以招募MK2作为备用通路。然而,MK2只恢复协调DNA损伤修复的能力,但不能启动细胞死亡。
Yaffe Group推出靶向MK2,仅在P53功能时唯一招募,这将是创造合成致死态的独特方式,通过阻断化疗后的促进DNA修复的能力,该合成致死性。实际上,Yaffe实验室能够在P53中的突变中展示非小细胞肺癌肿瘤的临床前模型,使MK2结合化疗治疗使肿瘤显着缩小。
虽然有希望,MK2已被证明难以吸毒。目前迄今为止,试图创建目标特异性,临床活的小分子MK2抑制剂。由联合领导作者领导的研究人员易文孔,然后是yaffe实验室的帖子,一直探索使用RNA干扰(siRNA)来停止MK2基因的表达,但siRNA在身体迅速降解的趋势提出了新的挑战。
进入纳米材料的潜力,以及一个纳米技术专家小组在保拉·哈蒙德实验室的研究。保拉·哈蒙德是大卫·h·科赫工程教授,麻省理工学院化学工程系主任,也是楼上亚菲小组的邻居。在那里,孔找到了当时的博士后Erik Dreaden,他的团队开发了一种名为nanoplex的运载工具,可以在siRNA到达癌细胞之前保护它。在对非小细胞肺癌模型的研究中,小鼠接受了mk2靶向纳米复合物和标准化疗,两者的结合明显增强肿瘤细胞对化疗的反应。然而,存活率的总体增加是显著的,但相对温和。
同时,孔已鉴定XPA,该蛋白质涉及另一个DNA修复途径,称为NER,作为MK2-P53合成致命组合的潜在补充。与MK2一样,使用传统的小分子药物靶向XPA的努力尚未成功地成功,并且RNA干扰作为团队的选择工具。哈蒙特组的纳米材料组装技术的灵活和高度可控性质允许Dreaden将SIRNA掺入XPA和MK2中的纳米复合物。
Kong和Dreaden在生物学教授Michael Hemann实验室和科赫研究所所长Tyler Jacks合作开发的免疫活性、侵袭性肺癌模型中测试了这些双靶向纳米复合物对已建立的肿瘤的治疗。他们让肿瘤在治疗前比之前的研究更大,从而提高了治疗干预的标准。
用双靶向纳米复合物和化学治疗的小鼠中的肿瘤单独降低高达20倍的化学疗法,并同样改善单靶纳米复合物和化疗。用这种方案治疗的小鼠比单独使用化学疗法才存三次,并且比仅靶向MK2或XPA的小鼠比例更长。
总的来说,这些数据表明,在P53,MK2和XPA之间的这种情况下,在这种情况下,识别和治疗靶向 - 在这种情况下,可以产生安全且高效的癌症治疗通过重新布线多次DNA损伤响应途径,其系统抑制可以是含有毒性的。
该纳米复合物是模块化的,可用于携带其他siRNA组合,或用于治疗与这种增强的合成致命组合相关的其他癌症。在肺之外的应用癌症包括目前在科赫研究所(Koch Institute)从事研究工作的Kong和目前在乔治亚理工学院(Georgia Tech)和埃默里医学院(Emory School of medicine)担任助理教授的Dreaden在内的研究人员正在研究这种治疗卵巢癌和其他癌症的方法。
进一步探索













用户评论