酶SSH1破坏了积累的细胞垃圾的处理,导致脑细胞死亡

在健康的大脑中,称为自噬的多体废物清关过程常规地除去并降解受损的细胞成分 - 包括畸形蛋白质,如Tau和有毒线粒体。否则这种细胞碎片将像未经摄影的垃圾一样堆积起来,以驱动脑细胞(神经元)的死亡,最终摧毁类似思维,记忆和推理的认知能力,阿尔茨海默氏症和某些其他神经变性疾病的患者。
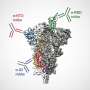
蛋白质P62是一种选择性自噬发生物受体,在清除错误的Tau蛋白和功能障碍线粒体中发挥了重要作用,该蛋白质线粒体在包括神经元的所有细胞中的能量推动力。通过自噬(意思是希腊语中的“自吃”)最终在溶酶体中消化和再循环,膜结合结构,如迷你废物管理植物。
现在,南佛罗里达大学的神经学家健康(普遍服务基金健康)伯德阿尔茨海默病中心报告第一次,蛋白磷酸酶Slingshot-1,简称SSH1,扰乱了p62的函数作为一个有效的“垃圾收集器”能力,从而会损害线粒体受损τ和泄漏的处置毒素。在一个临床前研究,研究人员表明,SSH1对Halting P62介导的TAU的保护性的影响与SSH1在激活辛脲的作用中分离,这是一种在恶化的TAU病理中起到重要作用的酶。
他们的研究结果发表在10月12日自噬。
“弹弓-1是调节tau蛋白和神经毒性线粒体水平的重要角色,所以理解当它们在大脑中积累时到底出了什么问题是很重要的,”该论文的资深作者、USF健康Morsani医学院的分子医学教授David Kang博士说。他是弗莱明阿尔茨海默病基金会主席,并担任伯德阿尔茨海默病中心基础研究主任。“这项研究对p62通路产生的缺陷提供了更多的见解,这将帮助我们开发SSH1抑制剂(药物)来阻止或减缓阿尔茨海默病和相关的神经退行性疾病。”
在他们的研究开始时,康博士的团队,包括第一作者和博士生方岑晓(Catherine Fang),医学博士,已经知道,在清除不良线粒体的情况下(称为线粒体吞噬),酶TBK1会短暂地将磷酸盐添加到p62。磷酸被专门添加在氨基酸403 (SER403)的位置,激活p62。然而,还没有科学家发现什么酶可以从p62中去除磷酸盐,即去磷酸化。
需要严格控制的磷酸化来平衡p62激活,这是启动货物受体识别和收集被泛素标记为“垃圾”的细胞废物的能力的早期关键步骤。简单地说,当自噬作用良好时,泛素化tau蛋白和泛素化线粒体被选择性地靶向收集,然后被自噬体(这一动态过程中的垃圾车)破坏和回收。但是,垃圾收集器p62不会接触细胞的健康(未标记)蛋白质和细胞器。
在一系列基因失活和过度表达实验中使用人体细胞系,原代神经元和跨部门病的小鼠模型,康的团队博士发现SSH1,专门用于SER403,作为第一酶去除P62的磷酸盐,导致P62停用。
“当某些东西超出平衡时,例如由阿尔茨海默氏菌素相关的蛋白Aβ过度激活,然后SSH1开始去除垃圾收集器P62的磷酸盐,基本上转移消息”停止,不做你的工作。'这导致了像损坏的积累一样的不良后果τ蛋白康博士说,有毒线粒体。
“如果我们可以通过抑制过度活跃的Slingshot-1抑制剂,使磷酸化调节恢复平衡,我们就可以增加p62清除有毒垃圾的正常活动。”
这种最新的研究在先前的USF健康研究中,表明,通过SSH1发生的Aβ-活化的Cofilin基本上踢出Tau,从而为神经元提供结构支持,从而提高Tau缠结在染色神经细胞内部的积聚。在位移过程中,Cofilin被传送到线粒体,并且随之而来的能量产生的线粒体损坏。跟进侧枝胶蛋白触发的伤害,康博士的团队预计会发现普遍的含有水噬细胞去除病态线粒体。
“我们得到了完全相同的结果,这意味着还有另一个机制影响弹弓-1如何受到监管线粒体康博士说,“结果证明,它包含了p62的关键自噬机制。”
研究人员还表明,两个主要和完全单独的信号传导途径与TAU病理到P62和另一种用于Cofilin的分别的信号通路 - 由相同的酶SSH1调节。
“除了SSH1-cofilin激活途径促进tau蛋白从微管迁移之外,这项研究强调了发散性SSH1-p62抑制途径在损害错误折叠tau蛋白的自噬清除方面的作用,”研究作者报告说。













用户评论