随着疫苗的临近,美国监管机构就棘手问题寻求建议
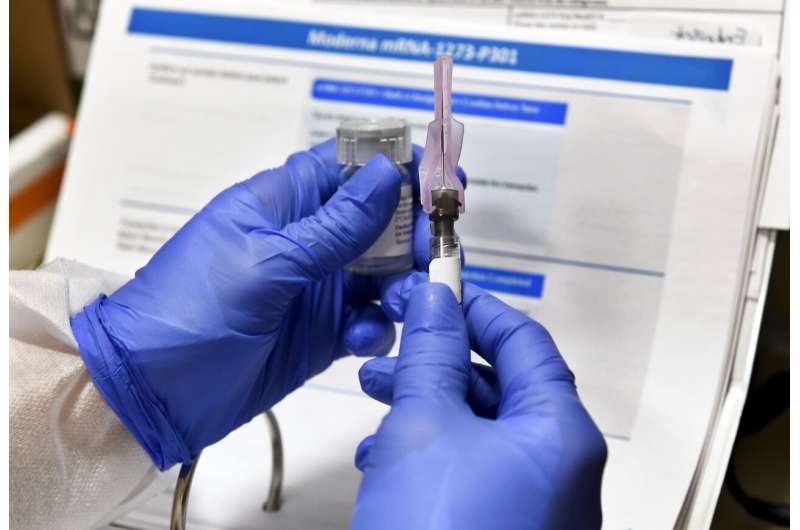
随着COVID-19疫苗的研制越来越近,美国监管机构周四采取了不同寻常的步骤,询问外部科学家:政府的标准是否高到足以充分判断疫苗?
美国食品和药物管理局(fda)可能必须在年底前决定是否允许使用针对冠状病毒的首批疫苗,因为公众越来越担心政治正在压倒科学。周四,一个联邦顾问委员会在长达一天的讨论中揭开了这一决策过程的帷幕,以确保没有偷工减料。
“疫苗的开发可以加快。然而,我想强调的是,它不能——也绝不能——操之过急,”FDA疫苗研究办公室主任Marion Gruber博士告诉顾问们。
格鲁伯说,公众的监督对于建立对任何一种疫苗的信任和信心都是至关重要的。
FDA究竟需要多少数据才能确保一种疫苗的安全和有效,这是顾问们面临的一个关键问题。随着主要疫苗开发商Moderna Inc.周四宣布,该疫苗的最终研究已经完成注册,这个问题也迫在眉睫。
一个更棘手的问题是:如果FDA允许在最终测试结束前紧急使用疫苗,这是否会破坏了解这些疫苗(或许还有正在研究的竞争对手)的真正效果的机会?
任何允许紧急使用的疫苗仍将是实验性的。目前可能还不清楚第一批疫苗是防止人们传播冠状病毒,还是只是防止人们患上严重疾病。流水线上有多个镜头——用不同的技术制作,每种技术都有利有弊——第一个镜头可能不是最好的。
FDA的多兰·芬克博士明确表示,该机构希望疫苗制造商尽可能多地让志愿者参与研究,以确定长期疫苗的安全性和有效性。
芬克说:“一旦做出了为正在进行的安慰剂对照试验开盲的决定,这个决定就无法撤销,对照后续试验也就永远丢失了。”但在被问及如何避免丢失这一关键信息时,他承认:“目前我没有任何具体的补救措施。”
周四的会议不是为了评估任何特定的射击。FDA承诺,在决定疫苗的命运之前,将重新召集顾问公开分析每一种疫苗。
但这是FDA试图向公众保证的一个机会,尽管来自特朗普政府的政治压力和疫苗研究的前所未有的速度,科学驱动的COVID-19疫苗审查正在进行。这种信心对于为数百万美国人接种疫苗的努力至关重要。美联社最近的一项民意调查显示,只有46%的受访者希望接种COVID-19疫苗,另有29%的人不确定。
人们的兴趣如此之高,FDA在YouTube上直播了这次会议。
委员会议程上的一些关键问题:
需要多少证据?
FDA要求生产商至少对3万人进行研究,以证明疫苗是否具有保护作用以及安全性。这些研究必须包括足够数量的covid -19高危人群——老年人、少数族裔和有其他健康问题的任何人。
FDA已经明确表示,任何疫苗必须至少有50%的有效性。虽然研究计划持续两年,但公司可能会得到足够的证据,证明疫苗至少对部分人具有保护作用,从而提前停止试验,并寻求所谓的“紧急使用授权”,以扩大疫苗接种范围。
尽管白宫反对,FDA本月早些时候告诉疫苗制造商,在他们追踪至少一半的试验志愿者两个月之前,不要寻求更快的审查。对于其他疫苗来说,这大约是主要副作用突然出现的时间。
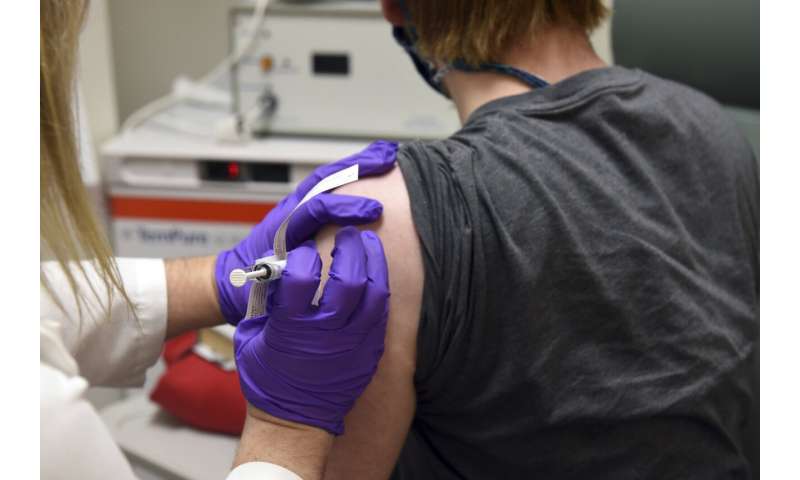
在美国进行最终测试的四种疫苗中,有两种由阿斯利康(AstraZeneca)生产,另一种由强生(Johnson & Johnson)生产,两种疫苗被暂时停产,以调查可能的副作用,因此安全性问题也越来越多。
美国国立卫生研究院(National Institutes of Health)的希拉里·马斯顿(Hilary Marston)博士说,这些暂停应该让人放心,这一过程是有效的:“我们发现这些事件是因为我们专门在寻找它们。”
但为医院和保险公司审查医疗技术的非营利机构ECRI Institute的负责人说,两个月的副作用跟踪期不够长。在提交给咨询委员会的评论中,ECRI的Marcus Schabacker博士说,FDA应该要求6个月的随访。
他写道:“如果不这么做,风险就太大了,后果可能很严重。”“一种失去公众信任的弱疫苗可能会在许多年里破坏疫情控制的井水。”
Moderna周四表示,超过三分之二的试验参与者已经接受了第二剂治疗,并正在朝着为期两个月的跟踪目标努力。该公司表示,其中包括了足够多在COVID-19中首当其冲的群体:约四分之一的志愿者年龄在65岁以上,47%来自少数族裔社区,包括6000多名西班牙裔和3000多名黑人参与者。
紧急情况下的使用会影响完整的答案吗?
通常情况下,当一项研究因为有证据表明疫苗有效而结束时,接受假疫苗注射的参与者会得到真疫苗。
但是,如果FDA允许紧急使用COVID-19疫苗,并且立即给安慰剂组的参与者注射真正的疫苗,研究人员可能无法得到研究中所有高危人群的答案,也无法知道疫苗的保护能持续多久,这一过程预计需要数月时间。
但辉瑞公司(Pfizer Inc.)告诉FDA,如果获得紧急使用授权,它“将有道德义务”提醒接受安慰剂的研究志愿者,并允许他们接种疫苗。该公司与德国BioNTech公司正在开发一种领先的候选疫苗。该公司希望FDA研究“其他科学和统计上合理的方法”,以确定长期的安全性和有效性。
辉瑞的立场可能会遭到抵制。美国传染病学会指出,FDA的专家小组“应该坚持”疫苗开发人员“提出一个令人信服的理由”,说明如果FDA提早批准他们的疫苗,他们将如何完成试验。
该组织表示,基于过早或错误的数据淘汰疫苗“可能会造成更多伤害”,因为“进一步削弱公众对所有疫苗的信心”。
这是一个前所未有的困境。FDA此前只允许紧急使用一种疫苗,即2005年被批准用于预防炭疽中毒的一种已有几十年历史的疫苗。
这一次,多种冠状病毒疫苗正在研发中。辉瑞的竞争对手强生(Johnson & Johnson)警告称,如果参与者决定退出,转而寻求第一针疫苗的批准,那么FDA对一种疫苗的早期批准可能会“危及正在进行的其他试验的完整性”。
那长期的安全监测呢?
即使是一项针对3万人的研究,也无法发现只有10万分之一的副作用。因此政府计划对上市的每一种COVID-19疫苗进行额外审查。
一开始,只给特定的高危人群有限的剂量,那些早期的接种者在接种疫苗后的第一周每天都会收到短信,然后每周到六周,询问他们的感觉如何。
FDA还将检查电子健康记录和保险索赔数据库,寻找任何危险信号。
©2020美联社。版权所有。未经允许,本材料不得出版、广播、改写或重新分发。










用户评论