揭示错误折叠蛋白质处理的新机制之路
大约30年前,理查德·西弗斯(Richard Sifers)博士开始了一段探索之旅,探究为什么患有一种名为α - 1抗胰蛋白酶(AAT)缺乏的罕见疾病的人在肝脏疾病的严重程度上存在高度差异。他的旅程使他发现了这种疾病的基本原理,并意外地发现了处理错误折叠蛋白质的一种新的细胞机制。后者不仅与aat缺乏有关,也与其他与缺陷蛋白积累有关的更常见的疾病有关,包括神经疾病,如阿尔茨海默氏症。
AAT缺乏症可能发生在携带突变Z的AAT基因的人身上。
“我开始研究AAT缺乏症是因为我对AAT的严重程度感兴趣。一些携带两个Z突变副本的人发展了肺部疾病晚年,有些人患上了肝病。有趣的是,这种情况也可能出现在生命的早期。一些新生儿和婴儿发展成严重的肝脏疾病,需要进行肝脏移植才能存活,”Sifers说,他是贝勒医学院丹·L·邓肯综合癌症中心的病理学和免疫学教授。
其他群体表明,1,700人中约1人携带两份AAT-Z基因。然而,只有约17%的新生儿患有Aat-Z患有临床显着的肝病,而且少于3%的人在威胁到危及生命,最终阶段疾病的婴儿。
Sifers的首要贡献之一是帮助开发了第一个筛查试验,以确定新生儿是否有罹患严重肝病的风险。
Sifers说:“开发这种筛查方法让我意识到,我可以判断一个孩子是否有患肝病的高风险,但仍然不知道是什么原因导致了这种情况。”
了解AAT缺乏
AAT是一个蛋白质由肝脏产生,并通过血液运输到肺部,在那里保护它们免受其他酶造成的损害,这些酶会分解肺中的蛋白质。Z突变产生一种缺陷的AAT蛋白,它不能折叠成适当的3-D构象。不适当折叠的AAT-Z蛋白不能离开肝脏,所以它们不能到达肺部以保护肺部免受破坏。这会导致肺损伤,导致肺气肿和其他肺部疾病。
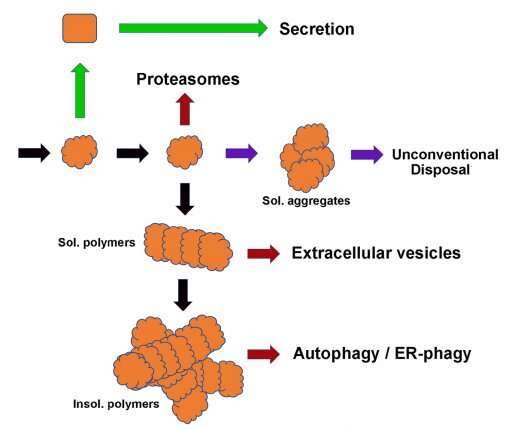
“正如我所研究的疾病一样,我注意到应该从肝脏释放的AAT-Z实际上积累了”Sifers说。“这表明细胞的自然处理机制可能不起作用。”
Sifers和其他人深入研究了细胞如何处理错误折叠的蛋白质。他们发现,细胞将有缺陷的蛋白质从它们的合成部位内质网(ER)运送到细胞质中,在那里它们被分解成一种被称为蛋白酶体的细胞结构。这个过程的关键是标记要破坏的蛋白质。
“我们表明,从蛋白质中取出某些糖将使它们标记为退化,”Sifers说。“具体而言,我们发现人酶甘氨酸酶MAN1B1作用于质量控制因子,介导从错误折叠的AAT-Z蛋白去除糖甘露糖,促进其降解。”
众多其他研究人员使用了AAT缺乏模型,研究病症也与细胞中错折叠的蛋白质的有毒积累有关,共同称为构象疾病。这种方法加速了对这些条件的潜在原因的理解,为潜在治疗提供了新的机会。
婴儿中Man1b1和AAT缺乏相关肝病的联系
虽然研究人员知道,与AAT缺乏相关的肝损伤与肝脏中错误折叠的AAT- z蛋白的积累有关,但仍无法解释婴儿严重的肝脏疾病。
在2009年的一篇论文中,Sifers和他的同事们研究了来自无亲属关系的婴儿或2岁以上因终末期肝病接受肝移植的儿童的肝脏组织样本。他们还用实验室培养的其他细胞进行了基因连锁和功能实验。
他们发现,特定的基因修饰,一种单核苷酸多态性,会导致Man1b1基因表达的改变,从而降低肝细胞内质网中Man1b1蛋白的水平。
Sifers及其同事提出,较低水平的MAN1B1损害肝脏的能力,以处理错误的AAT-Z的积累。这可能加速达到蛋白质积累的可容忍阈值,导致早期的肝功能衰竭。
拥有AAT-Z和一种减缓错误折叠AAT-Z蛋白处理的基因变异可以解释最年轻患者的病情。
“我很高兴经过多年的研究,我们找到了婴儿AAT缺乏相关肝病的解释,我想知道我的实验室是否会在未来做出其他重大贡献,”Sifers说。
Man1b1有不止一个角色
在Sifers和同事继续研究Man1b1的过程中,他们意外地发现了这种蛋白质以前从未描述过的作用。
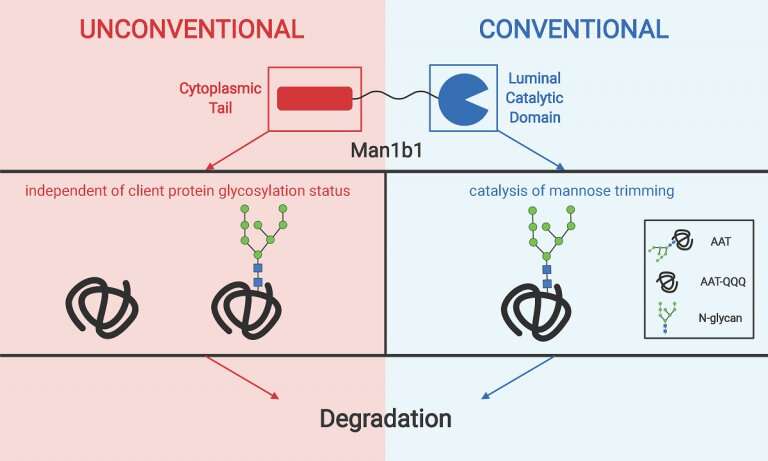
“我们发现,除了通过酶去除甘露糖基团来标记错误折叠的蛋白质降解,Man1b1还通过另一种独立于第一种机制的机制促进蛋白质降解,”Sifers说。
Sifers和他的合著者,Ashlee H. Sun博士(目前在polyypus转染生物技术公司工作),以及John R. Collette博士(他的实验室的博士后)在《纽约时报》上报道美国国家科学院院刊,传统的酶解去除系统位于Man1b1的一侧,即c端区域。相比之下,新的非常规体系被Man1b1的另一端,即n端区域所控制。进一步的研究将阐明这两个系统是否以及如何协同运作。
研究人员提出新的非传统系统可能参与消除与构象疾病相关的可溶性蛋白质聚集体。例如,人体MAN1B1已与智力疾病和艾滋病毒感染的多个先天性疾病的原因相关联,并对膀胱癌患者的预后不良。
“我们的作品是一个明确的例子,研究稀有疾病可以为更常见的条件带来解决方案。”
通过调查一个罕见的肝Sifers表示,婴儿患有婴儿的疾病,我们偶然发现了可能有针对性的途径,以防止在晚期发生的更常见的神经系统障碍。“
进一步探索










用户评论