研究确定了加快基于结构的抗COVID-19药物设计的新信息
一个新的论文自然通信概述了一个国际研究团队如何确定未来快速设计改进的、更有效的化合物以抗击COVID-19的潜在方法。 这项工作是为了开发一种针对SARS-CoV-2主要蛋白酶的抗病毒药物而进行的大规模片段筛选的结果。该项目由钻石光源生命科学副主任马丁·沃尔什领导;Frank von Delft,牛津大学结构化学生物学教授,I04-1/XChem at Diamond首席光束科学家;以及以色列魏茨曼研究所助理教授Nir London。该团队将质谱与英国国家同步加速器Diamond的XChem设施结合起来,快速识别用于治疗COVID-19药物开发的新先导化合物。
对于本研究,称为晶体和亲电片段筛选SARS-COV-2主要蛋白酶,该团队探讨了SARS-COV-2的必需酶,具有超过1,250个独特的小化合物,称为片段,并确定了74个高价片段命中,可用于开发新的抑制剂的这种必需病毒蛋白。本文详述了数据以及提出的设计路线,以改善,更有效,化合物。
“由SARS-COV-2引起的Covid-19缺乏有效的治疗方法。此外,没有抗病毒药物或针对密切相关的冠状病毒,SARS-CoV-1或MERS-CoV开发疫苗,尽管此前曾爆发过人畜共患疫情。为了确定这种治疗的起点,我们通过联合进行了亲电性和非共价片段的大规模筛选质谱以及x射线对SARS-CoV-2主要蛋白酶(病毒复制所必需的两种半胱氨酸病毒蛋白酶之一)的研究。我们的晶体屏幕识别出74个跨越整个活性位点的撞击,以及3个在二聚体界面的撞击。这些结构揭示路线快速开发更有效的抑制剂,并提供前所未有的结构和反应性信息进行基于结构的药物设计主要针对SARS-CoV-2蛋白酶,”马丁·沃尔什解释说他除了他在钻石的角色也是一个医学研究理事会(MRC)资助的研究组长ob欧宝直播nbaHarwell研究中心(RCaH)。

在2002年SARS-COV-1爆发之后,在药物开发中发挥关键作用的结构生物学也在2002年的SARS-COV-1爆发后迅速部署,并在Hilgenfeld组对冠心病的主要蛋白酶的主要工作导致SARS-COV-1的晶体结构蛋白酶和抑制剂复合物。其他研究采用了使用非常大的复合文库的高通量筛网(HTS)的流行方法,然后是结构研究以阐明结合模式。
“尽管有这些努力,毒品仍然难以瞄准SARS-COV-2(而不是疾病症状),并通过临床试验验证。回想起来,主要蛋白酶抑制剂可能是不熟练的,因为肽素和共价抑制带来风险作为药物开发的策略;一般来说,分子更简单,风险较低。因此,我们将不同的方法应用于这种蛋白酶,使用高吞吐量的片段筛选结构生物学,“加入马丁沃尔什。
片段法已经成为现代药物发现的主要方法,使用小的集合(100秒或1000秒)的小化合物(<300 Da),杂乱结合,因此样本的化学空间比HTS大得多。挑战在于,片段命中的非常弱的结合需要高度敏感的生物物理检测,仔细确认结合,以及专门的药物化学专家将这些打击发展成完全有效的候选药物。然而,如果有合适的专业技术和设备,碎片就能迅速有效地转化为有效的候选药物,并以更简单的途径产生临床影响。
-
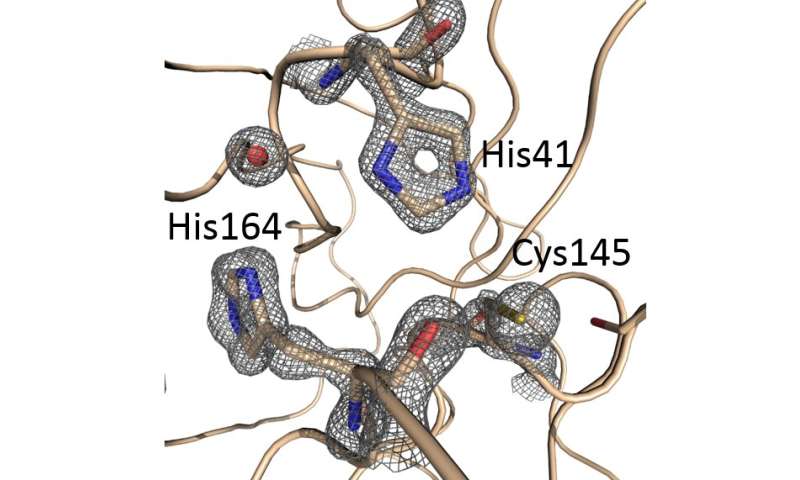
SARS-COV-2的结构主要蛋白酶:来自1.39埃结构的代表性电子密度(2fo-Fc映射在2.5°水平上,以1.39Å结构为中心的酶的活性位点。信用:钻石光源 -
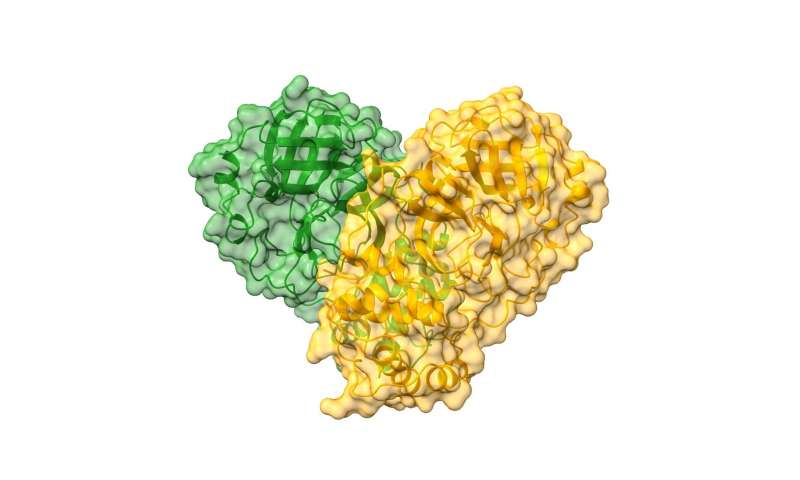
SARS-CoV-2主要蛋白酶的结构:CoVID-19二聚体的卡通图案,以绿色和橙色的半透明表面描绘每个单体。信用:钻石光源
同步辐射源的技术和自动化的快速进步已经在钻石光源的Xchem平台等设施中直接筛选晶体结构。一旦生成,该团队就掌握了高度不寻常的释放所有实验数据的路线;社交媒体的公告引发了一项大型的国际合作,通过新颖的众包倡议来利用全世界科学家的结合知识,他们称为Covid Moonshot。
“在几周内进行实验并在几周内实现高数据质量,作为锁定开始,是一个旅游的力量,以及我们高位才华横溢的科学家的信贷。更加出色的是国际社会对数据发布的回应:它动员了广泛的专业知识,技术和慈善事业,它发展成一个独特而严谨的药品发现努力,旨在迅速发展,易于一种新颖,易于合成的口服抗病毒,具有良好的安全性和临床前特性。完全在开放的工作,数据在实时发布,所以将向任何毒品制造商提供的结果。世界上的重点一直在疫苗和重新施加现有药物,但是Moonshot是尝试新的小分子治疗剂的少数项目之一,“Frank Von Delft说。
SARS-CoV-2是一种大的包膜阳性单链RNA乙型冠状病毒。病毒RNA编码两个开放阅读框,通过核糖体移框,生成两个多蛋白pp1a和pp1ab。这些多蛋白产生复制酶-转录酶复合物的大部分蛋白质。 该多聚蛋白由两种病毒半胱氨酸蛋白酶处理:一种类木瓜蛋白酶(PLpro),它可以裂解三个位点,释放非结构蛋白nsp1-3;另一种类丙型蛋白酶,也称为主蛋白酶(Mpro),它可以裂解11个位点,释放非结构蛋白(nsp4-16)。这些非结构蛋白形成复制酶复合物,负责病毒基因组的复制和转录,并导致Mpro和PLPro成为抗病毒的主要靶点药物开发。
进一步探索
















用户评论