通过红细胞将免疫刺激纳米颗粒输送到肺部可以阻止小鼠体内转移性肿瘤的生长
当癌症患者被告知他们的疾病已经扩散或转移到身体的新部位时,通常是转移到肺部。允许氧气从肺部气囊扩散到红细胞的分支血管是如此之小,以至于血液循环中的流氓癌细胞很容易卡在那里并定居,最终生长成继发肿瘤。转移性肿瘤一旦形成,就会释放出一系列化学信号,破坏身体的防御,阻碍诱导免疫反应的努力。肺转移是导致转移性疾病死亡的主要原因,目前还没有批准治疗肺转移的方法。
由于哈佛大学威斯生物工程研究所和约翰·a·保尔森工程与应用科学学院(SEAS)的研究人员开发的一项新技术,这种严峻的预测可能很快会变得不那么严峻。而不是看肺转移是一种不幸的后遗症原发肿瘤在其他地方,研究小组专注于通过红色将吸引免疫细胞的化学物质输送到肺癌中来治疗转移瘤本身血细胞.这种方法不仅阻止了转移性乳腺癌小鼠的肺肿瘤生长,还起到了疫苗的作用,保护动物免受未来癌症复发的影响。该研究发表在自然生物医学工程.
“我们的方法与传统的癌症治疗方法完全相反免疫系统识别和治疗原发肿瘤,因为这些肿瘤通常很大,很难治疗免疫细胞共同第一作者赵宗民博士说,他是威斯研究所和SEAS的博士后。“我们认识到,肺部的高密度血管为肿瘤提供了更好的途径,为诱导肿瘤提供了独特的机会免疫反应通过靶向转移。”
对难题的EASI解决方案
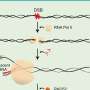
在不伤及身体其他部位的情况下,如何将药物输送到目标部位是医学的一大挑战。肝脏和脾脏在过滤血液中的任何外来物质方面的效率令人难以置信,这意味着通常需要给药大剂量,这可能会导致有害的脱靶副作用。克服有效治疗的障碍是Wyss核心教员Samir Mitragotri工作的主要重点,他的实验室最近发现,将充满药物的纳米颗粒附着在红细胞上,可以使红细胞逃避检测,并在体内停留足够长的时间,以传递有效载荷,同时最小化毒性。
赵和他的合著者决定使用这项技术,看看他们是否可以将免疫系统刺激化学物质输送到转移性肺肿瘤,而不是化疗,化疗会损害肺组织。他们选择了一种名为CXCL10的趋化因子作为有效载荷,这种趋化因子是一种吸引白细胞的小蛋白质。
“肺转移会消耗局部环境中的某些趋化因子,这意味着吸引有益白细胞对抗肿瘤的信号消失了。我们假设,在肿瘤部位提供趋化因子信号可以帮助恢复人体正常的免疫反应,使其能够攻击肿瘤,”联合第一作者Anvay Ukidve博士说,他曾是Wyss研究所和SEAS的研究生研究员,现在是一家制药公司的科学家。
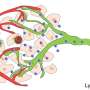
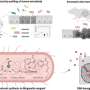
研究小组首先优化了纳米颗粒,以确保只有当红细胞通过肺部微小毛细血管时,纳米颗粒才会从宿主红细胞中分离出来。他们还用一种抗体装饰纳米颗粒的表面,这种抗体附着在肺血管细胞上常见的一种名为ICAM-1的蛋白质上,以帮助增加纳米颗粒在肺部的滞留。然后,这些纳米颗粒被趋化因子CXCL10填充,形成了一个被研究人员命名为免疫诱饵(ImmunoBait)的包。然后将免疫诱饵颗粒附着在小鼠红细胞上,创建一个名为红细胞锚定全身免疫疗法(EASI)的治疗输送系统,并将免疫诱饵注射到转移到肺部的乳腺癌小鼠的血液中。
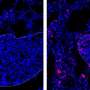
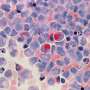
免疫诱饵颗粒在注射EASI后在动物肺中停留长达6小时,大部分分布在转移灶内和周围。EASI治疗导致CXCL10的强表达达72小时,这表明传递趋化因子刺激身体开始自己产生它,尽管有免疫抑制的肿瘤微环境。为了确切地找出传递的CXCL10对小鼠免疫系统的影响,研究小组分析了EASI注射前后肺中存在的不同类型的细胞。他们观察到T辅助1型(Th1) CD4细胞的浸润增加,CD4细胞释放促炎化学物质,帮助控制肿瘤,效应细胞CD8细胞和自然杀手(NK)细胞也增加,这些细胞推动直接杀死癌细胞。
本地注入,全局保护
有证据表明,他们的系统可以吸引免疫细胞到肺转移,然后研究小组在老鼠身上测试了其减缓或阻止疾病发展的能力。他们首先切除了动物的乳腺癌肿瘤(模拟患者经常接受的治疗原发性肿瘤的手术),然后向它们单独注射CXCL10、免疫诱饵纳米颗粒或EASI。
EASI对肺转移的抑制作用是游离CXCL10和免疫诱饵的4倍和6倍。所有接受easi治疗的小鼠在37天后的转移性结节少于20个,其中25%的小鼠只有一个结节。相比之下,接受其他治疗的小鼠有2到100个结节。接受EASI的小鼠存活率也提高了近三倍:尽管所有其他治疗组的动物在不到20天内就死于疾病,但接受EASI治疗的小鼠中约有25%存活了40天。他们也没有任何脱靶毒性的迹象或其他负面影响的治疗。
因为EASI有效地激活了免疫系统,防止肺转移,研究人员想知道这种激活是否可以提供持久的保护,防止同样的癌症未来复发。他们分析了接受EASI的小鼠的血液,观察到记忆CD8细胞的数量增加,这种细胞在免疫威胁后长期存在,并在威胁再次出现时发出警报。为了测试这些记忆细胞是否提供了足够的保护,研究小组在最后一次治疗两天后再次给小鼠接种了相同的肿瘤细胞。接受EASI治疗的小鼠的肿瘤生长和肿瘤重量明显低于注射盐水或不接受治疗的小鼠,这表明局部治疗肺转移产生了全身免疫肿瘤发展。
资深作者Mitragotri博士说:“这些发现突出了我们的EASI系统将转移的生物逆境转化为针对转移性癌症的独特治疗机会的能力。”Mitragotri博士也是生物工程的希勒教授和SEAS生物激励工程的Hansjörg Wyss教授。他的团队正在继续通过免疫诱饵纳米颗粒传递不同类型的趋化因子来优化EASI,并正在探索EASI与目前批准的癌症疗法的结合,以确定潜在的协同效应。
“这种独特的以生物为灵感的癌症治疗方法是我们在威斯研究所鼓励和支持的开箱思维的一个极好的例子——利用身体自身红细胞将药物输送到肺部的毛细血管中,在那里许多转移形成,Samir的团队已经开发了一种全新的免疫疗法,并打开了潜在的救生疗法的大门,”Wyss研究所的创始人主任Don Ingber说,医学博士,博士,他也是哈佛医学院的血管生物学Judah Folkman教授和波士顿儿童医院的血管生物学项目,同时也是SEAS的生物工程教授。