分子伴侣如何溶解与帕金森氏症有关的蛋白聚集体
在许多神经退行性疾病如帕金森氏症中,蛋白质聚集物在大脑中形成,并被认为是导致神经元细胞死亡的原因。然而,存在一种细胞防御机制来抵消这些聚集物,即淀粉样原纤维,甚至可以溶解已经形成的原纤维。这种防御机制是基于热休克蛋白70家族(Hsp70)的分子伴侣的活性,即蛋白折叠助手。
来自海德堡大学和德国癌症研究中心的分子生物学家研究了Hsp70系统是如何分解的淀粉样纤维的Parkinson-specific蛋白质试管中的α-synuclein。由贝恩德·布考(Bernd Bukau)博士领导的研究团队希望他们的研究结果能够为帕金森病的发展以及如何影响它提供新的见解。该研究结果发表在该杂志的两篇文章中自然。
所有细胞中的蛋白质,从细菌到人类细胞,都需要折叠成它们原有的状态。氨基酸构建块链具有特定的三维结构,赋予蛋白质功能。这种正确折叠的状态经常受到外部和内部影响的威胁,这些影响可能导致错误折叠,从而损坏蛋白质。有一种风险是受损的蛋白质会聚集或聚集成更长的链,即淀粉样原纤维。例如,α-synuclein在帕金森氏症中就会发生这种情况。而小纤维则是更大沉积物的起点。
海德堡大学分子生物学中心(ZMBH)和德国癌症研究中心(DKFZ)的研究员Bukau解释说:“这种纤维聚集物的形成过程会损害细胞,甚至导致细胞死亡,就像帕金森氏症和阿尔茨海默氏症等神经退行性疾病的情况一样。”
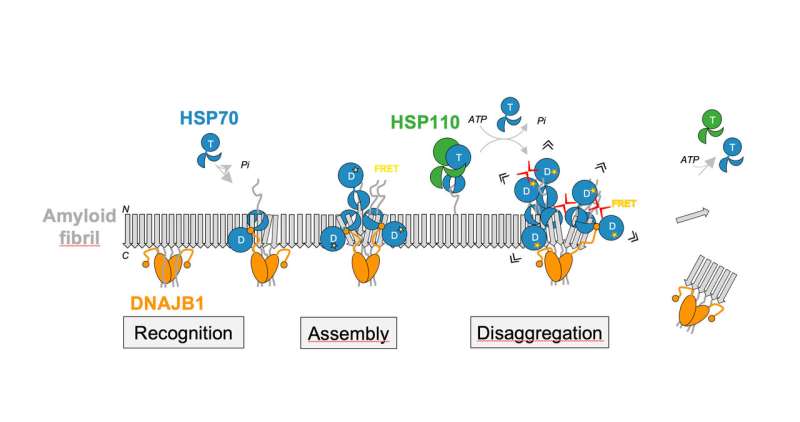
布考的研究重点是如何做到这一点蛋白质聚集可以溶解。在早期的工作中,他和他的团队成功地确定了一种在溶解纤维聚集物中起关键作用的细胞活动,这种活动基于热休克蛋白70家族的伴侣。Hsp70伴侣可以帮助其他蛋白质折叠,甚至可以分离和重新折叠聚集的蛋白质。Bukau和博士后Anne Wentink博士的最新研究表明,热休克蛋白70伴侣蛋白对帕金森病特异性α-synuclein蛋白淀粉样原纤维的影响。α-synuclein是一种小的蛋白质,在大脑中帮助释放被称为神经递质的信使,尽管它的确切功能尚不清楚。它之所以为人所知,是因为在帕金森氏症患者体内发现了大量这种特殊蛋白质的沉积,并与该疾病有因果关系。
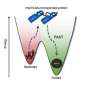
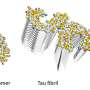
在生化实验中,海德堡的科学家最近能够证明人类Hsp70伴侣依赖于两个特定伴侣的协助来溶解α-synuclein蛋白的淀粉样原纤维。精确调控这些蛋白质的相互作用,导致在原纤维表面形成伴侣复合物,然后破坏聚集体。
“正是许多伴侣蛋白在α-synuclein原纤维表面的纯粹局部积累,产生了分裂原纤维和分离α-synuclein分子的力量,”Wentink博士解释说。在小纤维受限表面上的伴侣之间的接近在产生足够强的拉力来破坏小纤维中起着决定性的作用。
第二项研究发表于自然,主要研究了一种以前未知的调节机制,一种分子开关,它启动了Hsp70伴侣蛋白的整体活性,从而溶解淀粉样原纤维。这一机制是基于DNAJB1伴侣和Hsp70伴侣的不同部分之间的一系列直接相互作用。这最终激活Hsp70以ATP作为能量来源,使其能够有效地结合原纤维并影响其解体。
“这两项研究的最新结果让我们从分子层面了解了淀粉样原纤维是如何溶解的。我们能够证明伴侣像一台机器一样溶解纤维,”Bukau补充说。根据海德堡研究人员的说法,这为开发专门针对伴侣为基础的细胞防御机制的制剂开辟了新的途径淀粉样蛋白形成。更好地理解这是如何发生的伴护活动影响过程神经退行性疾病因此,在这些研究中所描述的研究结果的治疗开发中是至关重要的。
Ofrah Faust等人。HSP40蛋白使用类特异性调控来驱动HSP70功能多样性,自然(2020)。DOI: 10.1038 / s41586 - 020 - 2906 - 4https://www.nature.com/articles/s41586-020-2906-4








用户评论