通过网络建模,通过其复杂的分子相互作用的网络建模揭示了Alzheimer的潜在新疗法
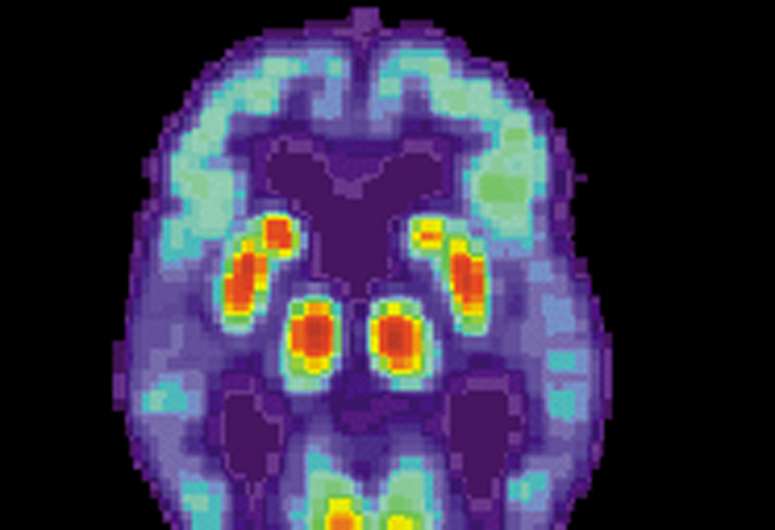
根据期刊的研究,山上西奈山和国家老年病毒学院和日本老年病毒学中心的研究人员确定了促进了促使晚期阿尔茨海默病(载荷)的新分子机制,以及有前途的治疗候选者。神经元。载荷是65岁以上人民中最普遍的痴呆形式,逐步和不可逆转的脑障碍影响美国超过550万人,以及第六名的死亡原因。
“我们的研究通过揭示其全球结构的揭示,但通过负载影响的关键脑区中复杂分子相互作用和法规的详细电路推进了对载荷发病机制的理解,”突袭教授,博士,博士,博士,博士博士表示,复杂的分子相互作用和条例的详细电路。西奈山伊恩医学院的基因组科学和转型性疾病建模中心主任。“我们创建的网络模型作为识别新的治疗目标的蓝图,该目标直接响应迫切需要预防,治疗和延迟载荷发作的新方法。”
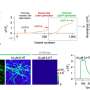
以前的遗传和基因组协会研究(GWAs)已经确定了一些基因突变与载荷相关,但疾病的因果变体仍然保持不协调。为了探讨推动负荷发病机制的分子机制,山上LED队伍的山脉从多个施主的多种皮质脑区进行了整个基因组和RNA测序数据集的整合网络生物学分析。这项工作揭示了数千分的分子变化,并揭示了在负载中进行了多重测定的许多神经元特异性基因子网。
从该调查研究人员预测,ATP6V1A是蛋白质编码基因,在大脑中的关键信号通路中起主要作用,并且其缺陷可以追溯到负载。使用两种方法评估该联动:一种基于CRISPR的技术,用于操纵捐赠者匹配的ATP6V1A水平脑细胞在体外,在转基因果蝇模型中的RNAi敲低敲低的,这意味着遗传物质人工被引入飞行模型中,特定基因有效地沉默以研究效果。实际上,在两种模型中,ATP6V1A的敲低恶化了载荷相关的神经变性。
正如显着一样,研究人员预测,药物化合物NCH-51可以使载荷的失调基因归一化,包括ATP6V1A,并证明NCH-51显着改善了两个模型系统中ATP6V1A缺陷的神经元和神经变性效应。具体而言,使用人诱导的多能干细胞(HIPSC)的基于CRISPR的实验表明,ATP6V1A的抑制,特别是与β-淀粉样蛋白-Aβ-淀粉样蛋白-A关键神经病理标志组合的广告撞击的神经元功能。“我们创造的基于人的制度被证明是建模克里斯汀布伦德,博士,博士教授,遗传教授,遗传教授,遗传学和基因组科学,委员会,西奈山和学习的共同作者。
果蝇的实验还揭示,证明ATP6V1A缺陷加剧了β-淀粉样蛋白介导的毒性和TAU介导的轴突变性。“这一发现表明,ATP6V1A可能具有广泛的神经保护作用,并作为其他与其与其他有关的神经变性疾病的潜在治疗目标,”Alzheimer疾病研究部门负责人的老年大肠杆菌及日本的长期学和研究的高级作者。
正如张博士所指出的那样,西奈山及其日本伴侣的突破性研究可能具有超越载荷的重要性。“我们已经为普遍进行了复杂人类疾病的高级建模框架,”他解释道,“这可能会导致发现分子机制和能够提供转化性新治疗的新型目标的鉴定。”
进一步探索












用户评论