科学家确定合成mini-antibody COVID-19作斗争
SARS-CoV-2感染细胞的能力取决于病毒突起蛋白之间的相互作用和人类的细胞表面蛋白ACE2。使病毒钩到细胞表面,使用三个指状突起,突起蛋白结合ACE2称为受体结合域(rbd)。挡住了rbd因此有可能阻止病毒进入人类细胞。这可以通过使用抗体。
Nanobodies、小抗体中发现骆驼,骆驼,很有前景,因为对病毒工具由于其稳定性高,体积小。虽然从动物获得他们是耗费时间,技术的进步现在允许快速选择合成nanobodies,称为sybodies。一个技术平台选择sybodies从大型合成库最近在实验室开发的马库斯·西格在苏黎世大学,并用于本研究。
寻找最好的sybody SARS-CoV-2
EMBL的汉堡的基督教低集团在现有图书馆找到sybodies阻止SARS-CoV-2感染人类细胞。首先,他们利用病毒突起蛋白的rbd作为诱饵来选择那些sybodies绑定。接下来,他们测试了所选sybodies根据其稳定性、有效性和绑定的精度。最好的绑定,一个叫sybody 23是在阻止rbd特别有效。
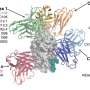
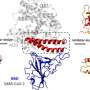
学习如何sybody 23与病毒rbd相互作用,研究人员在群Dmitri Svergun EMBL的汉堡分析绑定sybody 23日rbd的小角x射线散射。此外,马丁Hallberg CSSB和卡罗林斯卡医学院使用低温电子显微镜来确定结构的完整SARS-CoV-2飙升sybody 23。rbd在两个位置之间切换:在位置rbd戳出来,准备结合ACE2;在下来的位置他们收拢的躲避人类的免疫系统。分子结构显示sybody 23结合rbd的上下位置,并阻碍了区域ACE2通常绑定。这种能力阻止rbd不管他们的立场或许可以解释为什么sybody 23非常有效。
最后,测试如果sybody 23可以中和病毒姆瑞尔,本集团在卡罗林斯卡医学院用一种不同的病毒、慢病毒,修改,这样它SARS-CoV-2的峰值蛋白质表面。他们观察到sybody 23成功禁用修改后的病毒在体外。额外的测试将需要确认是否这个sybody可以停止SARS-CoV-2感染人体。
科学合作期间封锁
“协作精神是巨大的在这段时间里,每个人都积极贡献,“说基督教低,导致研究的科学家之一。研究者开始这个项目一旦他们收到EMBL的领导批准重新开放实验室在COVID-19锁定。他们设法选择候选人sybodies和执行分析在短短几周。
“如此迅速地得到结果仅仅是有可能的,因为我们使用的方法已经建立了其他研究项目与SARS-CoV-2无关。发展这些工具会耗费更多的时间和资源,“说低。
这个项目的结果伸出一个潜在的方法治疗COVID-19的承诺。在未来的工作中,科学家们将执行进一步的分析来确认是否sybody 23 COVID-19治疗可能是一种有效。
这项研究发表在自然通讯。
进一步探索