研究人员展示了如何在阿尔茨海默病中瞄准形状移位蛋白质
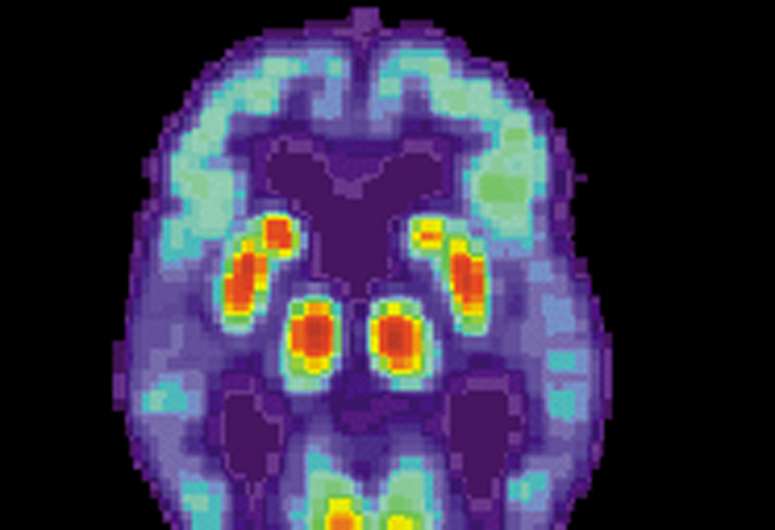
一项新的研究表明,设计针对一种与阿尔茨海默氏症有关的形状变化蛋白的药物是可能的,此前人们认为这种蛋白是不可用药的。
由剑桥大学领导的一个研究小组发现了一种针对β淀粉样蛋白的新机制蛋白质片段在阿尔茨海默氏症患者体内聚集并杀死健康的脑细胞。
与来自伦敦帝国理工学院、巴斯德研究所和佛罗伦萨大学的同事合作,研究人员发现这是可能的药物以淀粉样蛋白为目标,降低其形成毒性簇的能力,而毒性簇是阿尔茨海默病的标志。研究结果发表在该杂志上科学的进步,可以为开发潜在的治疗这种疾病的新途径奠定基础。
-淀粉样蛋白是一种紊乱蛋白质领导这项研究的剑桥错误折叠疾病中心的Michele Vendruscolo教授说。“它的形状一直在变化,所以传统的药物发现技术对它不起作用。通过揭示一种新的药物结合机制,我们扩展了传统的药物发现方法,该方法基于结合亲和力的优化,包括无序蛋白。”
大多数药物的工作原理是通过一种通常被描述为锁和钥匙的机制,将药物插入蛋白质的凹槽中,就像钥匙插入锁中一样。然而,由于它们经常改变形状,像-淀粉样蛋白这样的紊乱蛋白质没有稳定的“锁定”来与药物结合,这就是为什么它们被认为是“不可用药的”。
研究人员开发的方法是基于他们发现的所谓的无序结合机制小分子与蛋白质目标形成一个无序的复合物,这样就像是蛋白质和药物在相互“跳舞”。
研究人员利用生物物理实验、数学建模、体内实验和计算的结合来确定这一新机制的特征。
首先,他们在体外实验中测试了淀粉样蛋白在化合物存在时的聚集。来自这些实验的数据使研究人员能够建立一个数学模型药物如何在微观水平上抑制淀粉样蛋白的聚集。
该团队还使用高性能计算方法来研究原子级的绑定交互作用。这些密集的计算让研究人员能够“看到”原子层面上的结合是如何发生的,而这几乎是不可能通过实验观察到的。然后在线虫身上进行了进一步的测试,线虫经常被用作研究阿尔茨海默病的模型生物。
Gabriella Heller说:“在传统的锁和钥匙结合机制中,药物与特定构象的目标紧密相互作用,我们发现小分子和无序蛋白质都保持非常动态,而且小分子与蛋白质的许多部分相互作用。”施密特科学研究员和该研究的第一作者。
“这种稳定蛋白质州的这种方式是一种强大的药物发现策略,目前对无序蛋白质极其挑战,”Vendruscolo说。
该研究小组的目标是β淀粉样蛋白,它与阿尔茨海默氏症密切相关,因为它是老年斑的主要组成部分,而老年斑是该病患者大脑中特有的。
虽然这项研究在临床转化方面仍处于初步阶段,但它证明了通过阻止斑块聚集来靶向这些斑块的形成淀粉样β蛋白是一种主要的治疗策略。到目前为止,主流的方法是开发抗体来结合聚集体,促进他们的去除和干扰他们的自组装。
“无序蛋白质还与包括癌症和心血管疾病在内的一系列疾病有关。我们希望我们可以扩展这一了解,也针对与其他疾病有关的无序蛋白质,”海勒说。
进一步探索














用户评论