Tau蛋白变化与阿尔茨海默病痴呆阶段相关
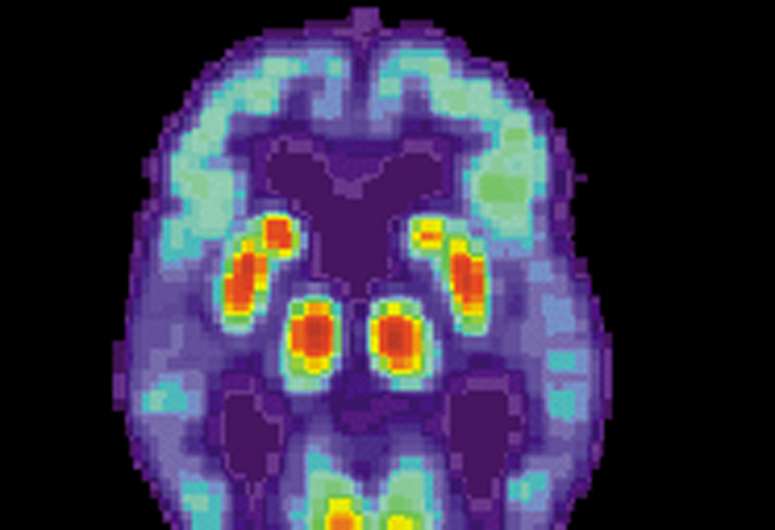
长期以来,对阿尔茨海默病的研究一直专注于了解两种关键蛋白质的作用,β淀粉样蛋白和tau蛋白。在患者脑组织的缠结中发现的一种病理形式的tau蛋白有助于疾病在大脑中的传播。
在他们联合实验室的新研究中,朱迪思·斯蒂恩博士和汉诺·斯蒂恩博士首次表明,这种病态tau蛋白蛋白质随着时间的推移,它的形式会改变,这可能意味着需要多种药物才能有效地针对它。
多年来,制药公司主要专注于开发针对-淀粉样蛋白的阿尔茨海默病药物,但收效甚微。最近,药物发现已经转向了抗tau的药物。这一新的tau蛋白发现可能有助于防止目前正在开发的针对tau蛋白的药物遭遇同样的命运,因为它表明这种蛋白质可能在疾病过程的早期阶段具有一组靶标,在疾病过程的后期阶段具有其他靶标。
“阿尔茨海默病中的tau蛋白在每个阶段看起来都不同,”首席研究员朱迪思·斯蒂恩说。“我们发现tau蛋白在与疾病严重程度相关的逐步过程中经历了一系列化学修饰。这表明我们需要对疾病的每个阶段进行不同的诊断和治疗。”
发表在一篇论文上细胞这项研究代表了Tau联盟资助的Steen实验室多年的工作。它的任务是加速阿尔茨海默氏症和其他与tau蛋白异常有关的疾病的新治疗方法的发现。
Tau蛋白随痴呆阶段而变化
Steen实验室团队从49名AD患者和42名年龄匹配的无已知阿尔茨海默氏症或痴呆症的个体中,观察了人脑两个区域——额回和角回组织中的tau蛋白聚集物。他们发现,阿尔茨海默病患者tau蛋白的化学性质发生了变化。这种tau蛋白有几种正常tau蛋白上没有的修饰,称为翻译后化学修饰(PTMs)。特定的化学修饰形式的tau蛋白与痴呆症阶段相关。
逐步化学修饰
随着年龄的增长,tau蛋白缠结在我们的大脑中积累,即使我们没有患上痴呆症。Steen说:“但是这些聚集物不那么丰富,看起来不像患有严重阿尔茨海默病的患者的tau聚集物。”她认为,tau蛋白在体内首次产生后会发生化学变化。他们的团队发现了95个tau蛋白的PTMs;其中大约三分之一之前没有描述过。
Steen说:“各种酶的化学处理对原始tau蛋白进行了修饰。”例子包括添加磷酸盐、甲基、乙酰基和泛素基团等。疾病的第一步似乎是从添加磷酸盐开始的,其他变化是逐步发生的。Steen说:“我们能够准确地看到这些变化是什么,变化的程度,我们还可以将其映射到tau蛋白的精确区域。”
可能需要一种以上的药物
该团队的发现对未来阿尔茨海默病的治疗有直接的影响。
Steen解释说:“为了成功地用抗体或小分子靶向tau蛋白,你可能需要不止一个抗体来清除它。”“与晚期阿尔茨海默病相比,早期干预可能需要不同的治疗方法,因为每个疾病阶段都有不同的PTM特征。”
研究小组希望,探索这些关键的化学修饰可能有助于解释阿尔茨海默氏症的发展和进展,并进一步揭示大脑的化学结构τ蛋白在早期阶段。
FLEXITau技术平台
这项研究的关键是使用了实验室开发的一种新的质谱技术来测量蛋白质。它被称为FLEXITau,在2016年的一篇论文中首次被描述,可以以前所未有的精度对tau的组成进行测序和量化。FLEXITau利用生物化学、质谱和数据分析提供tau蛋白化学修饰的信息大脑组织.
Steen实验室利用该平台研究了由美国国立卫生研究院资助的脑库从神经退行性疾病患者身上收集的脑组织,并用它来分析这些组织中的数千种蛋白质。
FLEXITau方法提供了对tau病理更深入的了解,团队认为这可能会导致新的治疗方法。它也可能有助于开发更好的诊断工具,以识别阿尔茨海默氏症和其他tau相关疾病的生物标志物。
进一步探索