更好地测试Car-T疗法的肿瘤靶向

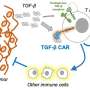
Ludwig癌症研究科学家已经开发了一种明显改善嵌合抗原受体(汽车)T细胞疗法的临床前评价的方法,其中免疫系统的T细胞从患者提取,工程化以靶向特异性肿瘤相关分子,然后生长并重新灌注癌症治疗。发表在这件事中实验医学杂志此次研究还报告了协同工程化的Car-T细胞的构建和评估,并适用于在皮肤癌黑色素瘤的小鼠模型中检查它们对肿瘤的影响。
尽管CAR-T疗法已被批准用于血癌,但将其应用于实体肿瘤已被证明具有挑战性。这在一定程度上是因为实体瘤以各种方式抑制免疫应答,尤其是通过募集各种抑制免疫细胞。
“大多数研究CAR-T疗法已经完成使用人类T细胞在小鼠体内缺乏自己的免疫系统,因为如果他们有一个,它会攻击人类CAR-T细胞,”欧文说马耳他,路德维希癌症研究所研究员洛桑分公司领导这项研究与路德维希洛桑导演乔治Coukos。”,但肿瘤微环境会对你的T细胞产品产生巨大的影响,所以我们非常感兴趣的是用工程小鼠T细胞在免疫功能小鼠中进行研究。这让我们可以观察免疫系统和我们移植的CAR-T细胞之间的动态相互作用。”
麻烦的是,小鼠T细胞难以在严格模拟Car-T细胞疗法所需的数量所需的数字中更难以成功,并且在文化中最佳地扩展。对于目前的研究来说,Ludwig洛桑队首先制定了克服这些困难的协议。其中,其中,其中,在工程化T细胞的培养和膨胀中,涉及称为白细胞介素(IL-2,7和15)的三种免疫信号分子的连续使用。
他们表明,使用该方案培养的Car-T细胞在暴露于目标时明显激活。细胞还显示出更年轻的迹象,并且在由其目标刺激时,内存T细胞具有常见的分子特征。
欧文说:“这意味着,当你转移这些细胞时,它们是非常健壮的细胞,真的可以迅速扩张来控制肿瘤。”
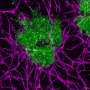
然后Irving, Coukos和他的同事们将他们培养的小鼠T细胞与嵌合抗原受体IL-15蛋白共同表达,促进记忆T细胞的形成。然后,他们检查了这些“第四代”(4G) CAR-T细胞对黑色素瘤小鼠模型的疗效,并将它们的活性与使用新方案产生的普通小鼠CAR-T细胞的活性进行了比较。
“我们看到更好的瘤IL-15表达CAR-T细胞的控制,以及更好的CAR-T细胞本身的增殖和持续性,“IRVING。4G CAR-T细胞也容易易于编程细胞死亡,表达较低水平的细胞表面蛋白质名为PD-1,其促进T细胞自杀。
他们的分析表明,4G Car-T细胞不仅仅有效地杀死癌细胞。他们还重新编程肿瘤的微环境以增加这种杀戮。它们的使用导致了自然杀伤细胞的激活 - 靶向癌症细胞- 在肿瘤微环境中,抑制抗肿瘤免疫应答并支持肿瘤生长的M2巨噬细胞的显着下降。
欧文说:“我们希望这项研究方案的发表将有助于T细胞工程界,并使T细胞治疗的临床前评估更加可靠。”











用户评论