BioNTech,辉瑞要求欧洲好的疫苗应急使用
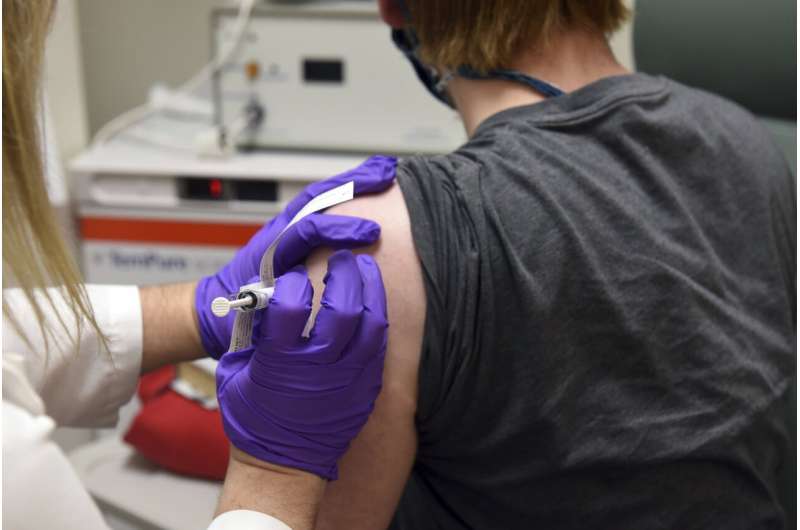
德国BioNTech和它的美国合作伙伴辉瑞制药公司说他们已经提交申请有条件批准,与欧洲药品局的冠状病毒疫苗。
两家公司周二说,提交,周一发生,完成轧制审查过程他们发起机构在10月6日。
此举一天前竞争对手现代化说这是要求美国和欧洲监管机构允许紧急COVID-19疫苗的使用。
目前名为BNT162b2 BioNTech说,如果这种疫苗,被批准后,它的使用在欧洲可能在2020年底之前开始。
公司上个月说临床试验与成千上万的参与者显示疫苗功效率为95%。的成功率在特别脆弱的年龄更大的年龄组是超过94%,他们说。
BioNTech和辉瑞公司已经提交了一份紧急请求批准与美国食品和药物管理局和英国监管机构MHRA,以及滚动提交在其他国家包括澳大利亚、加拿大和日本。
“我们知道这趟旅程的开始以来,病人在等待,我们随时准备船COVID-19疫苗一旦潜在的授权允许我们,“辉瑞首席执行官艾伯特Bourla在一份声明中说。
德国的科学部长周二说,相同的安全标准被应用在审批过程冠状病毒至于其他药物和疫苗,这将是获得尽可能广泛的公众接受的关键COVID免疫。
安雅Karliczek告诉记者,教育津贴将在柏林举行公开听证会在12月11日批准请求BioNTech和辉瑞。
她补充说,该疫苗将是自愿的,当局将努力工作来告知公众关于可能的副作用,可能在免疫后,如头痛、局部疼痛和发烧。
美国阿多,医生在汉堡的尤克里里琴医院参与试验的疫苗,对手说的快速发展疫苗被科学家们巨大的努力的结果,从以前的疫苗早期资金和经验。
进一步探索
©2020美联社。保留所有权利。材料可能不会被出版,广播,重写或重新分配。









用户评论