FDA批准销售ACL植入物
日前,美国食品药品管理局(fda)宣布,一种提供传统ACL重建替代方案的前交叉韧带(ACL)植入物已获得美国食品药品管理局(fda)的上市许可,这是30多年来首次批准ACL撕裂治疗。
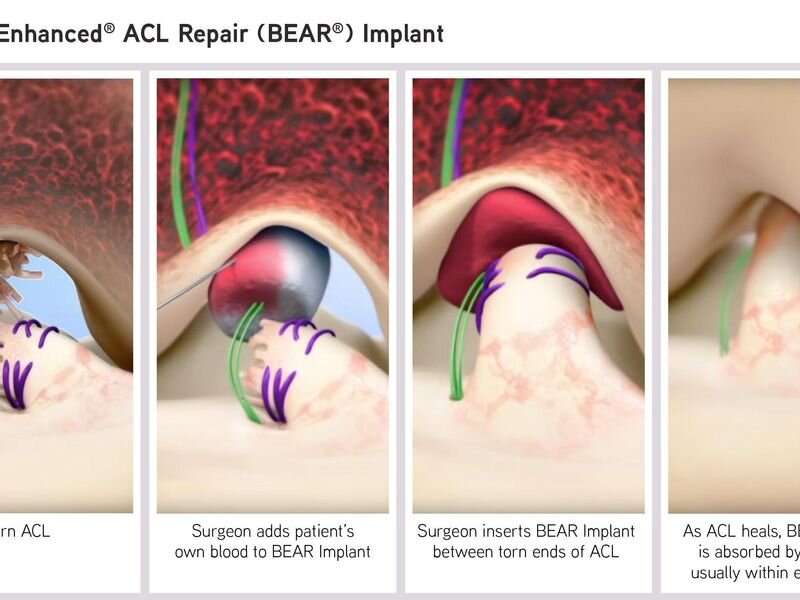
Bridge-Enhanced ACL Repair (BEAR)植入物获得了De Novo上市前审查途径的批准,这是FDA对一种新型低到中风险设备的监管途径。这种由牛胶原蛋白制成的可吸收植入物是目前唯一可用的替代品重建采用同种异体移植、自体移植或仅缝合修复ACL破裂。该批准适用于年龄在14岁以上、骨骼发育成熟、经磁共振成像证实ACL完全破裂的患者。ACL残端必须附着在胫骨上以构建修复。
外科医生通过缝合固定BEAR植入物,并将患者自己的血液注射到植入物中,形成一个设备保护的凝块,从而使身体的愈合过程得以进行。根据美国食品药品管理局的说法,手术后大约八周内,植入物就会被人体自身组织吸收和替换。
BEAR种植体的批准是基于BEAR II临床试验的数据,显示该种植体对14- 35岁患者ACL重建的非劣势性。在100例完全ACL破裂患者的随机对照试验中,65例患者接受了BEAR种植体,35例患者接受了a对照组采用自体移植物进行ACL重建。两年后,国际膝关节文献委员会的平均主观评分分别为BEAR种植体组和对照组的88.6和84.6。在两年的关节测量评估中,接受了BEAR植入的患者的平均松弛度比未接受治疗的患者的平均松弛度大1.7 mm,而对照组患者的平均松弛度大1.8 mm。
Miach Orthopaedics Inc.获得了上市许可。该公司表示,计划进行有限的市场发布植入物在2021年初。
版权©2020每日健康。保留所有权利。










用户评论