隐藏的酶网络占Alzheimer脑突触的损失
斯克里普斯研究所的科学家们揭示了大脑中一个此前未知的生化级联反应,它会导致突触的破坏。突触是负责记忆和认知的神经细胞之间的连接。
该研究结果提出了一种新的角度,用于发现治疗阿尔茨海默病的药物,这影响了全球大约5000万人。该研究由Scripps Research教授和Step Family Foundation赋予STUART Lipton,MD,博士,博士,博士,博士,博士,博士,博士出现在杂志科学。
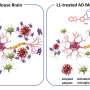
这一新发现的一系列异常化学反应,被称为“蛋白质亚硝基化转化反应”,导致突触丧失,这是阿尔茨海默氏症中记忆丧失和认知能力下降的主要原因。
利普顿同时也是一名临床神经学家,他解释说,最近开发阿尔茨海默氏症治疗方法的尝试都是针对一种名为β淀粉样蛋白积累在患者的大脑中,破坏细胞通信并引起炎症。然而,由于各种原因,这些尝试在临床试验中失败了。
“这项工作为我们提供了新的希望,以获得更好的治疗目标,因为我们发现的反应是淀粉样蛋白作用的下游,”Lipton说。“我们已经开辟了一个全新的药物发展途径。”
利普顿对治疗阿尔茨海默氏症和帕金森氏症的药物开发并不陌生。由他的实验室开发并获得专利的药物导致了四种fda批准的治疗这些疾病的药物,包括广泛使用的药物美金刚胺(Namenda)。“然而,我们需要更好的药物,”Lipton说。
一个化学成功的故事
在新的研究中,Lipton和他的团队使用物理化学技术来量化电子如何参与化学反应,因为他们怀疑未知的过程可能在大脑中发生。通过这个实验,他们揭示了阿尔茨海默氏症影响的神经细胞中一系列全新的生化事件。
他们发现β淀粉样蛋白的小团块引发过量的神经元活性和炎症,导致破坏性系列跨亚硝基化反应。
该方法以过量的氮气(n)和氧(O)原子作为“无基团”的氧(N)和氧(O)原子初始,然后将其转移到称为半胱氨酸的蛋白质构建块中以调节蛋白质的活性。一系列这些异常的蛋白质反应通过破坏其对细胞的生化反应产生动力的线粒体细胞器来切断脑神经细胞的能量。这最终导致突触突触连接神经细胞。
“我们能够证明这些反应发生在阿尔茨海默氏症患者的大脑中,当我们阻止这些反应发生在该疾病的动物模型的大脑中,我们就保护了突触,”Lipton说。他补充说:“我们的研究结果表明,尽管有斑块和缠结,但有可能通过调解逆转突触损伤。”他指的是-淀粉样蛋白的“斑块”和错误折叠的tau蛋白的“缠结”,这两者都是阿尔茨海默病的特征。
他指出,虽然正常的寄养记忆和学习的水平,但过度的水平可以随着年龄的增长而建立并对突触有害。
“有了这项新知识,我们可能能够在阿尔茨海默氏症患者的大脑中形成大量的斑块和缠结后恢复突触连接,”利普顿实验室小组的资深科学家、该研究的第一作者中村智宏博士补充说。
揭示秘密联系
Lipton表示,该团队最令人难以置信的调查结果之一是发现沿着沿着一系列事件链传递给彼此的三种酶,导致能量失败,导致能量失败,甚至没有被认为彼此远程相关。每个酶在完全不同的正常生物化学途径中,它们在完全不同的正常生物化学途径中是重要的,但它们以新颖的方式在疾病条件下进行触发强烈的神经元应力和突触损伤。
“这种类型的隐藏或‘幽灵’途径可能只会在疾病条件下变得明显,并且可能代表了我们以前为什么不了解疾病过程的一个重要的基本原则,”Lipton说。“如果我们不知道某种途径,科学家就无法研究它对疾病的影响,或开发出治疗它的药物。”
虽然已经发现了许多分子生物化学途径,但过分依赖现有的证据实际上会阻碍发现疾病过程,他补充道。
“因此,这项工作中最重要的方面是我们必须在我们的守卫中寻找现有酶的新途径和新的关系,以便理解和治疗诸如阿尔茨海默氏症等神经变性障碍,”Lipton说。
进一步探索












用户评论