研究揭示了触发Covid-19典型细胞因子风暴的免疫机制
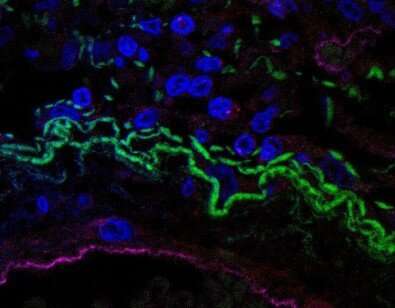
巴西圣保罗大学(USP)的研究人员首次证明,在COVID-19患者中,一种被称为炎症小体的免疫机制参与了炎症过程的激活,可损害多个器官,甚至导致死亡。
由FAPESP支持的一篇报道该研究结果的文章刚刚发表在实验医学杂志。根据作者的说法,这些发现支持使用炎症活化既可作为疾病预后的标志,帮助医疗队在早期阶段识别高危患者,又可作为严重COVID-19的潜在治疗靶点。
“已经批准用于人类的药物能够抑制炎症小体的激活。这些药物现在可以在SARS-CoV-2感染的环境中进行测试,”USP Ribeirão Preto医学院(FMRP-USP)的教授、该研究的首席研究员Dario Zamboni告诉Agência FAPESP。
几乎所有的免疫细胞都配备了构成炎症小体的蛋白质复合物,他解释说。当其中一种蛋白质识别出危险信号,例如病毒或细菌颗粒,防御机制就会被激活。结果,细胞进入了一个程序性死亡的过程(一种被称为坏死的炎性死亡),并向血液中释放一种被称为细胞因子的信号分子,这些细胞因子吸引了大量的白血细胞。这是炎症反应的开始,最终旨在破坏对生物体的潜在威胁。
“对各种病原体的反应涉及炎症体激活,并且大部分时间阻断感染并保护生物体。然而,在一些Covid-19患者中,国防系统似乎是过度激活的,我们现在试图了解原因这发生了,“Zamboni说。
这种免疫机制在过去几个月的几个国家的科学家研究了严重Covid-19特征的全身炎症中。RibeirãoPRETO组是第一个证明患者SARS-COV-2的感染的特定类型炎性炎症的激活。
“重要的是要记得有不止一种炎症。有什么不同的是蛋白质,其负责介导激活的蛋白质蛋白质复合体”,Zamboni说。“我们观察到NLRP3介导的炎症小体的存在,这是最常见和研究得最充分的蛋白质之一。其他种类也可能参与应对SARS-CoV-2。”
三个角度的调查角度
本文的结论是基于三组实验得出的。第一个涉及感染了这种新病毒的健康捐赠者的免疫细胞冠状病毒在实验室。实验中使用的唯一白细胞是单核细胞。
他说:“这种培养物的病毒剂量被认为很低,大约每个细胞一个病毒。即便如此,75%的单核细胞在24小时后死亡,证明了该病毒的破坏性。”Zamboni说。
培养基中乳酸脱氢酶(LDH)的存在告诉研究人员,通过糊化瘤细胞死亡:当细胞膜破坏和细胞内容物逸出到血液中时,LDH被释放,炎症细胞死亡的现象。细胞因子IL-18(白细胞介素-18)和IL-1β(白细胞介素-1β)的存在表明,这种“连续细胞自杀”与NLRP3炎性的激活相关,通过显微镜下的分析证实。
“当这种炎症小体被激活时,形成复合物的蛋白质通常分布在细胞质中,聚集在一起形成所谓的斑点,在显微镜下可以观察到,”Zamboni说。“这反过来又激活了caspase-1,这种酶‘处理’炎症前细胞因子如IL-18和IL-1β的前体,从而使它们变得‘成熟’和活跃。”
第二组实验涉及由FMRP-USP经营的一般和教学医院(“医院DeClínicas”)在4月和7月之间进行中度或严重Covid-19进行治疗的124名患者的临床样本。将结果与来自住院的患者的数据进行比较,以其他原因作为对照组。
研究人员进行了免疫酶检测(基于抗原抗体反应),并使用分子探针证实,COVID-19患者的白细胞中IL-18和活性caspase-1的平均含量要高得多。
他们在显微镜下观察到,SARS-CoV-2感染供体的免疫细胞中斑点更为丰富。统计分析表明,患者入院时炎性小体激活的证据越多,患者的临床进展越差,死亡的概率越高。
第三组和最后一组实验使用了在受到SARS-COV-2感染后的五个人的微创尸检程序期间获得的肺组织样品。分析证明存在受病毒感染的白细胞的存在,以及细胞内部NLRP3炎症的斑点特征。
下一个步骤
迄今为止执行的分析由FAPESP通过专题项目和授予Zamboni的常规研究资助,他也是炎症疾病(CRID),研究,创新和传播中心(Ridc)的研究中心的成员由fapesp并由fmrp-USP托管。
同一组40多名研究人员目前正在研究其他类型的炎症小体是否参与了对新型冠状病毒的反应,以及病原体为何如此强烈地激活这种免疫机制。
Zamboni说:“我们正在进行实验,对SARS-CoV-2和其他病毒(如H1N1流感病毒)的反应进行炎症小体激活的比较。”
另外,科学家们正在测试使用药物来抑制严重Covid-19患者的NLRP3炎性。有前途的初步结果已发表在Medrxiv。
“我们正在寻找能够在临床试验中抑制NLRP3炎性的其他药物,”Zamboni说。“我们发现更多关于inflammasomeCOVID-19的激活机制,我们可以更有效地确定减少炎症过程的药物。”















用户评论