研究发现了导致脑疾病中蛋白质结块的新机制
西部储备大学医学院的一支研究人员致力于了解理解涉及形成大块TAU蛋白的机制,阿尔茨海默病的标志和其他几种神经退行性障碍的机制。
他们的发现可能有助于更好地理解病理过程,并且可能导致发展药物以治疗这种毁灭性的脑病。
本周在本周在期刊上发表了“在液 - 液相分离条件下的Tau蛋白颤动的调节机制”国家科学院的诉讼程序。
该研究的高级作者是医学院的生理学和生物物理学教授Witold Surewicz。Solomiia Boyko,A研究生这项研究得到了美国国家老龄化研究所(National Institute on Aging)的支持。
阿尔茨海默病的疾病是脑神经细胞死亡的特征,导致逐步记忆损失和认知下降。根据Alzheimer的协会,美国超过500万人患有阿尔茨海默氏症的人,这个数字将预计将于2050年投射到三倍。这种毁灭性疾病没有治愈。
在阿尔茨海默病的疾病中,Tau蛋白的团块开始在大脑中的神经细胞内形成。这些聚集体的脑积累被称为“神经纤维纤维缠结。"
类似的tau蛋白缠结在神经细胞间传播,也与许多其他神经退行性疾病有关,统称为“tau蛋白病”。这些疾病包括匹克氏病、额颞叶痴呆、进行性核上麻痹和慢性创伤性脑病。
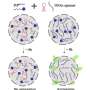
最近的研究表明,与其他一些其他蛋白质一样,TAU可以经历液液相分离,这是形成含有高浓蛋白质的液体样液滴的过程。这种现象,类似于在混合时用油和水分开的现象,被认为对细胞的正常功能很重要。然而,在某些条件下,细胞内的这种分离也可能具有病理后果。
这项新研究在这两种现象——tau液-液相分离和缠结形成——之间建立了一个关键的联系,表明液滴的环境极大地促进了tau凝聚成纤维结构,这与阿尔茨海默病患者大脑中发现的结构类似。
研究人员还描述了这一机制液-液分离阶段当存在Tau蛋白的不同变体存在时调节块状。特别是,作者表明,由于液滴的独特性质,存在较短,慢慢聚集的Tau变体抑制更长,通常快速的聚集变体的块,减慢缠结形成的整体过程。
这种新的调节机制可能在决定疾病的临床结果中发挥重要作用,因为这两种tau变异在不同的tau病中大脑的比例有很大的差异。
例如,阿尔茨海默病的特征通常是两种tau蛋白异构体的比例相等,而进行性核上麻痹和匹克病的纤维缠结主要分别由较长和较短的变体组成。
“虽然目前的结果为TAU的病理团块的形成提供了激动人心的新见解蛋白质“我们的研究仅限于试管中纯化蛋白质的实验。下一步是在细胞和动物模型中验证这些发现疾病。"
进一步探索













用户评论