ACTIV-3试验结果发表:实验单克隆抗体在三期试验中无效
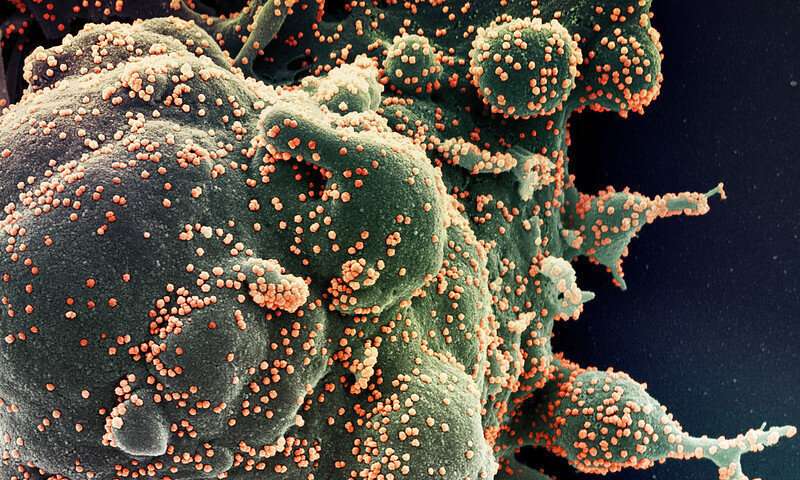
在住院的COVID-19患者中测试研究性单克隆抗体LY-CoV555的一项三期随机、安慰剂对照临床试验的初步结果今天发表在新英格兰医学杂志.与安慰剂相比,抗体没有提供临床益处。根据独立的数据和安全监测委员会(DSMB)的建议,该试验于10月底暂停,直到新注册。该试验是加速COVID-19治疗干预和疫苗(ACTIV)项目的一部分。该试验是由国家过敏和传染病研究所(NIAID)赞助的,NIAID是国家卫生研究院的一部分。
ACTIV-3试验使用了一种主方案,旨在对COVID-19住院成人患者进行多种研究制剂与安慰剂的比较。ACTIV-3的参与者被随机分配接受一种实验药剂或匹配的安慰剂。所有参与者还接受COVID-19住院患者的标准护理,包括抗病毒药物瑞德西韦。入组5天后,根据顺序量表对受试者的临床状况进行评估。如果根据对前300名参与者(第一阶段)的评估,研究药物似乎是安全和有效的,那么另外700名参与者随机随访90天,以评估持续恢复,定义为出院、活着和回家14天(第二阶段)。终末期器官衰竭的患者不在第一阶段登记,但如果试验进展到第二阶段,则允许登记。
第一个在ACTIV-3中评估的药物是LY-CoV555。这种单克隆抗体是由总部位于温哥华的AbCellera Biologics公司与NIAID的疫苗研究中心合作发现的。随后,它由位于印第安纳波利斯的礼来研究实验室(Eli Lilly and Company)与AbCellera合作开发和制造。
10月26日,在DSMB审查了试验第一阶段的数据后,该试验对新入组者关闭,并建议不再随机接受LY-CoV555治疗,并对研究人员进行数据揭盲。这一建议是基于干预在这一没有终末期器官衰竭的住院患者群体中具有临床价值的可能性很低。LY-CoV555子研究的注册人数为326人,其中314人随机接受LY-CoV555(163人)或安慰剂(151人)。5天后,50%的LY-CoV555接受者和54%的安慰剂接受者属于两个最有利的结果类别之一。研究人员得出结论,在没有终末期器官衰竭的住院COVID-19患者中,与安慰剂相比,LY-CoV555在第5天没有加速临床改善。同样,与安慰剂组相比,LY-CoV555组患者在出院时间或持续康复的主要结局(在家14天)方面没有差异。
虽然LY-CoV555的表现并不优于安慰剂在本次试验研究的住院COVID-19患者中,这种试验性单克隆抗体于11月获得了美国食品和药物管理局(fda)的紧急使用授权(EUA)。EUA批准将LY-CoV555用于有轻度至中度COVID-19症状、发展为严重COVID-19疾病风险较高的非住院青少年和成人。
ACTIV-3试验正在世界范围内的现有医院进行临床试验网络。领先网络,全球艾滋病毒试验战略行动国际网络(INSIGHT),得到了NIAID的支持。合作临床试验网络包括急性肺损伤预防和早期治疗网络(PETAL)和心胸外科试验网络(CTSN),由NIH国家心肺和血液研究所通过评估COVID-19和治疗策略网络合作网络(CONNECTS)项目和美国退伍军人事务部医疗中心提供支持。











用户评论