两种抗病毒酶将白血病前干细胞转化为白血病
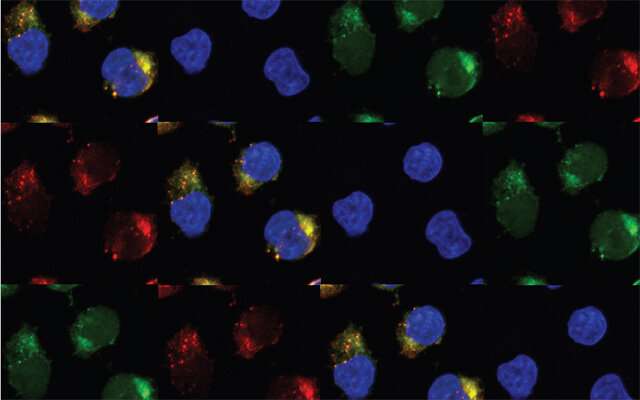
由于干细胞可以不断地自我再生,产生更多的干细胞,并分化成许多不同的特化细胞类型,它们在我们的发育和健康中发挥着重要的作用。但也可能有一个黑暗的副作用干细胞有时会变成癌症干细胞,增殖失控,导致血癌,如白血病和多发性骨髓瘤。癌症干细胞的自我更新特性使它们特别难以根除,它们经常是血癌复发的原因。
加州大学圣地亚哥分校健康和加州大学圣地亚哥医学院的研究人员正在努力了解是什么推动了pre- Diego癌症干细胞转化为癌症的根茎细胞并且正在研究阻止这种转变的方法。
他们的最新学习,公布了2021年1月26日细胞的报道在白血病中,APOBEC3C和ADAR1这两种酶协同工作,为癌症前干细胞向癌症干细胞的转化提供燃料。APOBEC3C和ADAR1都被炎症分子激活,特别是在机体对病毒的免疫应答过程中。
研究人员还发现,通过使用两种现有的治疗骨髓纤维化的药物fedratinib或ruxolitinib抑制ADAR1,他们可以在实验室中防止白血病干细胞的形成。骨髓纤维化是一种罕见的骨髓癌症。
“apobec3c和adar1就像癌症前干细胞的邦妮和克莱德 - 他们将细胞驱动到恶性肿瘤中,”Co-Senuity Catriona Jamieson,MD,博士,众议院,副校长兼咨询癌症研究Moores癌症中心主任,桑福德干细胞临床中心主任,在UC San Diego Health的Cirm Alpha干细胞诊所主任。
Jamieson的团队长期以来一直在研究ADAR1,这是一种编辑细胞遗传物质以控制哪些基因在什么时间打开或关闭的酶,以及它在白血病干细胞中的作用。他们之前还发现,高ADAR1水平与多发性骨髓瘤患者的生存率降低相关。
在他们的新研究中,研究人员收集了54名白血病患者和24名健康对照参与者捐献的血液干细胞和唾液样本。他们比较了从患者身上收集的白血病前干细胞和白血病干细胞的全基因组序列。他们惊奇地发现,APOBEC3C和ADAR1的水平在白血病干细胞的发展过程中都有上升。APOBEC3C通常帮助细胞保持基因组稳定性。
研究小组发现,在对炎症的反应中,APOBEC3C促进了人类白血病前干细胞的增殖。这为ADAR1奠定了基础,ADAR1在编辑过程中变得过于热心,以支持白血病干细胞的方式扭曲了基因表达。当研究人员在实验室中抑制了病人细胞中ADAR1的激活或沉默该基因时,他们能够阻止该基因的形成白血病干细胞。
APOBEC3C, ADAR1及其在癌症干细胞现在是贾米森在国际空间站(ISS)内建立第一个专门干细胞研究实验室的nasa资助项目的重点。
这是因为美国宇航局的双胞胎研究——对在国际空间站上呆了6个月的同卵双胞胎斯科特·凯利和留在地球上的马克·凯利进行了全面的生物学比较,发现斯科特返回地球后血液中的炎症生长因子、免疫失调和癌症前突变有所增加。这些分子变化是激活APOBEC3C和ADAR1的完美条件,持续了近一年。
Jamieson说:“在我们NASA任务订单的支持下,我们现在正在开发APOBEC3C和ADAR1抑制剂,作为宇航员的风险缓解策略,因此我们有希望预测和防止在近地轨道和深空任务中癌症前干细胞的产生。”
该团队还对进一步探索两者之间的联系感兴趣病毒感染和癌症。杰米森说,病毒感染会引发细胞因子的大量分泌,这是一种有助于刺激身体免疫力量的分子。作为这种反应的一部分,ADAR1被激活以帮助免疫细胞增殖。
“我们需要APOBEC3C和ADAR来帮助我们对抗病毒,”她说。“所以现在我们想知道,这些酶在对COVID-19的免疫反应中发挥作用吗?”这也会有不利的一面吗?之后对病毒感染的免疫反应是否会增加一个人患癌症前干细胞发育的风险并最终导致癌症干细胞的产生,我们能否进行干预以防止这种情况发生?”
进一步探索














用户评论