伴随着无序蛋白质的啤酒花可能导致阿尔茨海默病的未来治疗

来自剑桥大学的研究人员,米兰大学和谷歌研究已经使用了机器学习技术来预测蛋白质的方式,特别是那些涉及神经系统疾病的蛋白质,在微秒的问题中完全改变它们的形状。
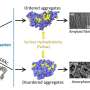
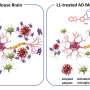
他们发现淀粉样蛋白β, 一种关键蛋白涉及在阿尔茨海默病的疾病中,采用高度无序的形状,实际上变得不太可能粘在一起并形成导致脑细胞死亡的有毒簇。
结果,在期刊中报道自然计算科学这将有助于未来发展蛋白质紊乱疾病的治疗方法,如阿尔茨海默病和帕金森病。
“我们习惯于思考蛋白质作为折叠成明确的结构的分子:了解这一过程如何发生在过去50年中的一个主要研究重点,”来自剑桥的错误折叠疾病的疾病的疾病教授说这个调查。“然而,大约三分之一的蛋白质在我们的身体中没有折叠,而是留在混乱的形状,汤中的那样像面条。”
我们对这些无序蛋白质的行为知之甚少,因为传统的方法倾向于解决确定静态结构的问题,而不是确定运动中的结构。研究人员开发的方法利用了谷歌计算机网络的能力来生成大量短轨迹。最常见的运动在这些“电影”中多次出现,这使得我们可以定义无序蛋白质在不同形状之间跳跃的频率。
“通过计算这些运动,我们可以预测哪种状态蛋白质占据了它们之间的转换速度,“来自Cambridge的Yusuf Hamied化学系。
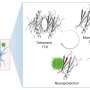
研究人员专注于他们的注意力β淀粉样蛋白肽,与阿尔茨海默病相关的蛋白质片段,聚集形成淀粉样斑块在受影响个体的大脑中。他们发现-淀粉样蛋白在不同的状态之间以每秒数百万次的速度跳跃,在任何特定的状态下都不会停止。这是疾病的标志,也是目前为止淀粉样蛋白被认为是“不可用药”的主要原因。
Vendruscolo说:“β淀粉样蛋白的持续运动是很难锁定目标的原因之一,这几乎就像在你的手上抓烟一样。”
但是,通过研究淀粉样蛋白β的变体,其中一个氨基酸被氧化修饰后,研究人员对如何使其抗聚集有了初步了解。他们发现它被氧化了淀粉片改变形状的速度甚至比它未修改的对应物更快,这为解释氧化版本聚集的减少趋势提供了一个理论依据。
“从化学的角度来看,这种修饰是一个很小的变化。但它对两者之间的状态和转换的影响是巨大的。”Löhr说。
Vendruscolo说:“通过使无序的蛋白质更加无序,我们可以防止它们以异常的方式自我结合。”
该方法为研究一类具有快速和无序运动的蛋白质提供了强有力的工具,尽管它们在生物学和医学上很重要,但迄今为止仍然难以捉摸。











用户评论