母亲胎盘中的雌激素受体在病毒感染时至关重要
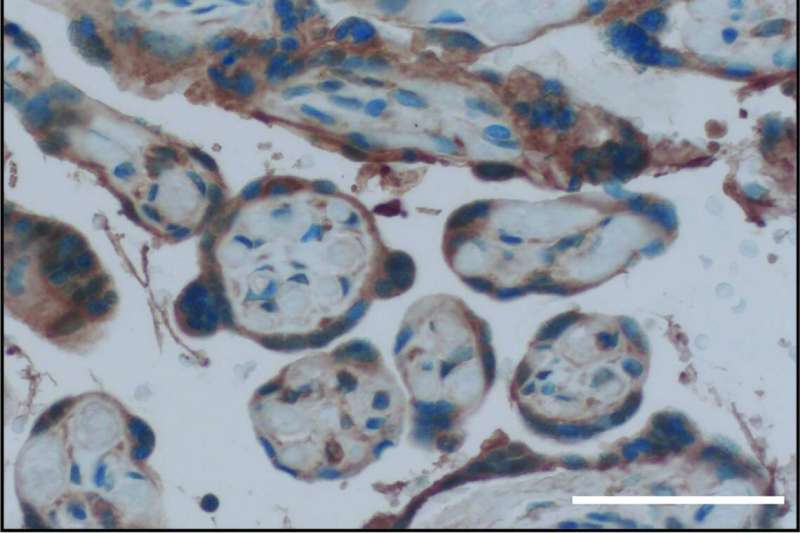
杜克和山的研究人员西奈鉴定了一种分子机制,可防止在母亲怀孕期间伤害她未出生的婴儿的病毒感染。
当一个人被一个人感染时病毒它们的免疫系统会发出一种叫做I型干扰素的化学信号,这种信号会告诉周围的细胞增强它们的抗病毒防御能力,包括增加炎症。
这种反应有助于防止病毒自我复制,并提供适应性免疫系统有更多的时间来了解新的入侵者并开始追捕它。
一个孕妇谁遇到病毒会产生同样的信号来保护自己,但如果信号分子由此产生的炎症能够穿过胎盘到达胎儿,它们会导致严重的发育异常甚至胎儿死亡。
但除了Zika病毒和少数人以后造成胎儿并伤害它,除了Zika病毒和少量其他病毒之外不会发生这种情况。(尽管近1800万报告的Covid-19迄今为止迄今为止,但没有强大的证据表明导致疾病的病毒SARS-COV-2对胎儿构成威胁。)
研究团队发现了一种保护胎儿免受母亲免疫反应对病毒的影响可能导致的机制可能导致。在一个晚上的纸上科学,它们鉴定该途径中的关键球员,作为称为GPER1的细胞表面雌激素受体,其在胎盘和胎儿组织中特别丰富。
“这可能解释了为什么怀孕期间许多母体感染不会伤害胎儿,”杜克医学院的分子遗传学助理教授尼古拉斯·洪都斯
通过一系列的筛选,研究人员发现GPER1可能是这种效应的候选者,GPER1受体集中在胎盘中,母亲的血液供应将氧气和营养物质传递给胎儿。怀孕期间雌激素水平高得多,使得GPER1受体能够更好地抑制胎盘和发育中的胎儿中的干扰素信号。
研究人员试图用一种叫做G15的化合物来阻止怀孕小鼠体内的这种特殊的雌激素受体。他们发现,在甲型流感病毒感染或G15治疗期间,胎盘发生了变化,导致幼鼠略小。但在G15和流感病毒同时存在的情况下,幼崽显著变小,许多都是死胎。
他们还测试了感染寨卡病毒和B型流感病毒的怀孕小鼠,发现添加G15治疗再次导致更多的胎儿缺陷。
“如果我们禁用GPER1通路,即使是正常的良性母体感染(如流感)现在也会导致重大的胎儿发育问题,”希顿说。
希顿称其为一种途径,因为他的团队还不明白GPER1是如何提供这种保护的。他们怀疑该受体触发了其他起作用的下游机制。
希顿说这个系统集中在婴儿周围的好处是它能保护胎儿从炎症,在留下母亲的其他组织的同时更能够使用干扰素来对抗病毒。
研究人员下一步将进行测试,看看当母亲被病毒感染时,GPER1通路的“过度激活”是否可以保护胎儿发育。












用户评论