LCMC3:Neoadjuvant Atezolizumab Safe,符合病理反应率的主要终点
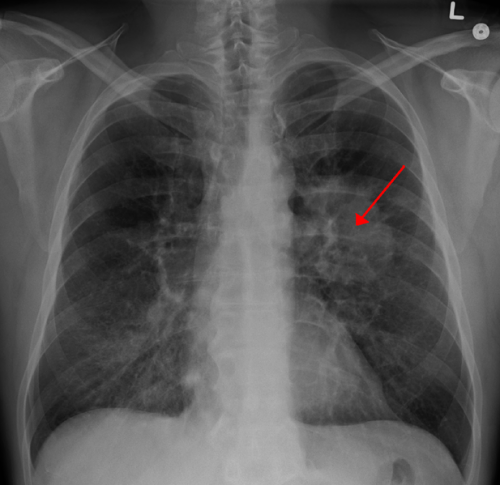
肺癌突变联盟(LCMC)的初步分析3研究表明,患者肺癌手术前的Neoadjuvant atezolizumab均受良好的耐受性,并根据今天在国际协会的研究中达到其主要病理反应率的主要终点。肺癌世界肺癌会议研究。
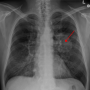
洛杉矶罗纳德里根州罗纳尔州罗纳州罗纳州罗纳尔·莫拉医疗中心的胸部手术博士博士报告了181名患者IB患者的研究结果。小细胞肺癌(NSCLC)每三个星期接受每三个周期的每三个周期接受1,200毫克Neoadjuvant atezolizumab,然后进行切除。atezolizumab是2020年由美国食品和药物管理局批准的单克隆抗体,用于成年患者转移NSCLC的一线治疗。
李博士早些时候报道,小型试验研究(NENGL J MED。2018; 378:1976)表明了术前免疫检查点抑制剂治疗可能是可被转移的NSCLC中的益处。李博士表示,“LCMC3研究是可重置的NSCLC中最大的检查点抑制的单药治疗试验,并且是一个具有比较未来结果的地标研究。”
患者接受Neoadjuvant atezolizumab两个循环,然后从第一个循环开始切除30到50天。受益于治疗的患者继续佐剂atezolizumab 12个月。主要终点是具有EGFR或ALK突变的患者的主要病理反应(MPR;在手术中少于或等于10%活肿瘤细胞)。
在注册的181名患者中,中位年龄为65岁;51%是女性,90%是当前/前吸烟者,62%的人有一个非问题的组织学。患者分类为以下阶段:17名患者在IB中暂存;20是IIA,55例IIB,72例IIIa,17个是IIIB。
在没有EGFR / ALK突变的患者接受手术的情况下,主要的病理反应率为21%(30/144; 95%CI:14%-28%)和病理完全反应率为7%(10/144; 95%CI:3%-12%)。
“重要的是要认识到,LCMC3中的术前和术中不可切除性率与历史新辅助化疗试验相当,不应引起关注,”李博士说。在atezolizumab之后,在181名(12%)中仅22个(12%)和159分中的70分中,术前检测到不确定性,其中7%(4%)。大多数患者(151/159; 95%)有解剖学肿瘤切除术,101(15%)中只有15个(15%)转化为胸廓切开术。在155(%)中有66个出现病理下降。159名(12%)中只有19个(12%)在协议窗口之外的手术。
术中并发症是罕见的(5/159; 3%),159名(92%)中的145例已经完全(R0)切除。术后不良反应与切除的样品中的减少可活肿瘤细胞相关。30天和30至90天的死亡率每1分为159例(0.6%)。
“追随Neoadjuvant.atezolizumab.李博士李议员说,在新辅助治疗结束后,切除在新辅助治疗后,近期围手术期发病率和死亡率安全地进行了低围手术期的发病率和死亡率,“这些发现代表了完整的LCMC3研究的主要分析。”这些发现代表了完整的LCMC3研究的主要分析并且与我们以前的结果一致,包括一个初步报告在其中的一部分耐心[在] 2019。“
“在早期NSCLC的多学科方法中,免疫疗法和有针对性疗法的整合代表了优先事项,”Scagliotti,Insim IASLC CSO博士说。“IASLC目前正在通过多种举措培养国际合作。”










用户评论