对心脏和神经有毒的蛋白质可能有助于预防老年痴呆症
一种蛋白质,当它聚集在一起时,在神经和心脏中造成严重破坏,可以防止与阿尔茨海默病相关的有毒蛋白质团块,由UT Southwestern研究人员显示的一项新的研究。最近发表的调查结果生物化学杂志,可以导致这种脑蹂躏的疾病的新治疗,目前没有真正有效的疗法,也没有治愈。
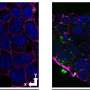
研究人员长期以来,已知蛋白质的粘性斑块已知为β淀粉样蛋白是阿尔茨海默氏症的标志,对脑细胞有毒。早在20世纪90年代中期,在这些斑块中也发现了其他蛋白质。
UTSW的阿尔茨海默氏症和神经退行性疾病中心的生物物理学助理教授Lorena Saelices博士解释说,其中一种被称为转甲状腺素(TTR)的蛋白质似乎起着保护作用,该中心是小Peter O'Donnell大脑研究所的一部分。当被塑造成阿尔茨海默氏症模型的老鼠被基因改变以产生更多的TTR时,它们发展成类似阿尔茨海默氏症的状况的速度较慢;类似地,当他们产生更少的TTR时,他们的病情发展得更快。
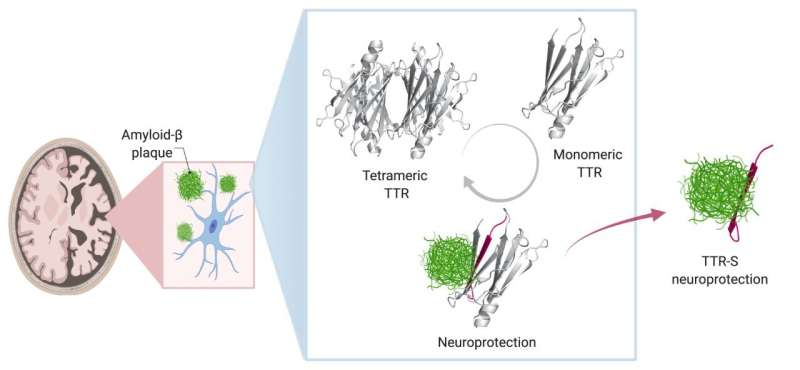
在健康的人和动物中,Saelices增加,TTR有助于将甲状腺激素和维生素递送到身体中所需的位置。对于这项工作,TTR形成四聚体 - 类似于具有四个相同传单的三叶草的形状。然而,当它分成称为单体的分子时,这些单个件可以像淀粉样蛋白在心脏和神经中形成粘稠的纤维,并形成有毒的结块,从而导致罕见的淀粉样变性疾病。在这种情况下,淀粉样蛋白在器官中积累并干扰它们的功能。
Saelices想知道TTR在预防和引起淀粉样蛋白相关疾病方面是否存在与TTR的单独角色之间的联系。“这似乎是如此巧合,即TTR有这样对立的功能,”她说。“这既可能是保护和破坏性的?”
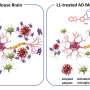
为了探索这个问题,她和她的同事们开发了9种不同的TTR变体,它们有不同的倾向于分裂成聚合的单体,形成粘性原纤维。有些人动作很快,在几个小时内完成,而另一些人动作缓慢。还有一些则非常稳定,根本不会分解成单体。
当研究人员将这些TTR变体与淀粉样蛋白β混合并将它们放在神经元细胞上时,它们发现淀粉样蛋白β仍然有氧含量差异。将单体分离成单体并迅速聚集成纤维的变体提供了一种免受淀粉样蛋白β的保护,但它是短暂的。那些分成单体但花费更长时间的人提供了明显更长的保护。并且那些从未分开的人根本没有提供免受淀粉样蛋白β的保护。
Saelices和她的同事怀疑TTR的一部分与淀粉样蛋白β结合,防止淀粉样蛋白β形成自己的聚集。然而,当该蛋白质处于四聚体形式时,该重要的TTR似乎被隐藏。当然,计算研究表明,当叶片连体中可以粘附淀粉样蛋白β时,计算研究表明这种蛋白质被隐藏。
然而,这片倾向于坚持自己快速形成团块。通过化学标签修改本件以停止自我关联,研究人员产生了可以防止在溶液中形成有毒淀粉样蛋白β结块的肽,甚至分开预先形成的淀粉样蛋白β斑块。修饰的TTR肽与淀粉样蛋白β的相互作用导致转化为含有酶容易分解的无定形聚集体的形式。此外,改性肽防止了淀粉样蛋白'播种,'从阿尔茨海默病患者提取的淀粉样蛋白β的原纤维的方法可以模板形成新的原纤维。
Saelices和她的同事们目前正在测试这种修饰过的TTR肽能否在小鼠模型中预防或减缓阿尔茨海默氏症的进展。如果他们成功了,她说,这个蛋白质片段可以形成这种顽固条件的新治疗的基础。
“通过解开TTR的双重作用之谜,”她说,“我们也许能给阿尔茨海默氏症患者带来希望。”
进一步探索








用户评论