蛋白质基因组学为治疗头颈部鳞状细胞癌提供了见解
蛋白质基因组分析可能为匹配癌症患者与他们特定癌症的有效治疗提供新的见解。一项新的研究确定了头颈部鳞状细胞癌(HNSCC)的三种分子亚型,可以用来更好地确定适当的治疗。该研究由贝勒医学院、约翰霍普金斯大学和美国国家癌症研究所临床蛋白质组肿瘤分析协会(CPTAC)领导,发表在该杂志上癌细胞。
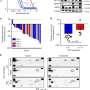
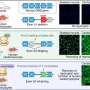
研究人员在108人乳头瘤病毒阴性HNSCC肿瘤中,研究人员分类蛋白质,磷酸水和信号通路,以了解遗传畸变如何驱使肿瘤行为和对疗法的反应。目前,HNSCC存在少数FDA批准的疗法,包括表皮生长因子受体(EGFR)单克隆抗体(MAB)抑制剂和两个PD-1抑制剂,但反应率是中等的。在这项研究中,研究人员旨在了解为什么某些患者应对某些治疗,以更好地与患者匹配适当的治疗过程。
“我们发现了头颈部的三种亚型鳞状细胞癌并且每个亚型可以是不同类型的治疗 - EGFR抑制剂,CDK抑制剂或免疫疗法的良好候选者,“林章博士博士说,莱斯特和苏史密斯乳房中心和分子部的研究贝勒的人类遗传。“我们还确定了可用于将患者与患者进行有效疗法或临床试验的候选生物标志物。”
寻找有效的生物标志物
一项重要的发现涉及到将头颈部鳞状细胞癌患者与EGFR mAb抑制剂匹配。西妥昔单抗(Cetuximab)是一种EGFR单抗药物,于2006年获得FDA批准,成为首个治疗头颈部鳞状细胞癌的靶向治疗药物,但成功率较低。此外,EGFR扩增或过表达不能预测对EGFR单抗的反应。在本研究中,研究者发现EGFR配体,而不是EGFR本身,是EGFR通路激活的限制因子。配体低时,即使EGFR蛋白高过表达,也不会触发下游通路。
“我们提出了EGFR配体应用作生物标志物,而不是EGFR扩增或过表达,以帮助选择患者为EGFR单克隆抗体治疗,”丹麦邓肯综合癌症中心成员,一种癌症预防德克萨斯州(CPRIT)学者研究所和贝勒的麦克纳尔学者。“具有高EGFR扩增的肿瘤并不一定具有高水平的EGFR配体,这可能使其缺乏对EGFR MAB疗法的反应。”该团队通过分析来自患者衍生的异种移植模型和临床试验的先前公布的数据来确认了这一假设。
此外,跟踪称为RB(视网膜母细胞瘤)的关键肿瘤抑制剂,研究团队确定了一个引人注目的发现,表明RB磷酸化状态可能是患者对CDK4 / 6抑制剂治疗的反应的更好指标。该研究表明,调节CDK4 / 6活性的基因中许多突变既不是必要的,也不足以激活CDK4 / 6。该团队发现CDK4活性最好通过RB磷酸化测量来测量,因此鉴定CDK抑制剂临床试验中患者选择的潜在措施。
免疫疗法见解
研究团队还发现了对免疫疗法的有效性的重要见解。PD-1抑制剂靶向免疫检查点PD-1和PD-L1之间的相互作用,但是即使当PD-L1表达用于患者选择时,免疫疗法的成功率也是低的。研究人员检查了PD-L1高表达的肿瘤,发现当肿瘤过表达PD-L1时,它还上调其他免疫检查点,因此尽管使用Pd-1抑制剂,但仍允许肿瘤生长。该观察结果表明,具有热免疫环境的PD-1和PD-L1活化肿瘤可能需要多种类型的免疫疗法,其靶向不同的免疫检查点蛋白,以有效。
相反,免疫环境寒冷的肿瘤不是免疫治疗的好目标。对肿瘤如何变成免疫冷肿瘤的检查显示,问题源于其抗原提呈途径的缺陷,其中抗原提呈途径的多个关键基因成分被删除。因此,尽管肿瘤抗原被表达,但免疫系统不能在细胞表面识别它们,因此不能激活身体的防御系统来抵御肿瘤瘤。这些缺失有可能成为未来治疗的有效靶点。
该研究的共同通讯作者Daniel W. Chan博士说:“这项研究扩展了我们对hpv阴性的头颈部鳞状细胞癌的生物学理解,并提出了治疗假设,这可能为未来的研究和临床试验奠定基础,以分子引导精确药物治疗这种侵袭性癌症类型。”他是约翰霍普金斯大学医学院(Johns Hopkins University School of Medicine)的病理学和肿瘤学教授,也是生物标志物发现和转化中心(Center for Biomarker Discovery and Translation)的主任。
进一步探索











用户评论