抗癌药物的操作模式破译
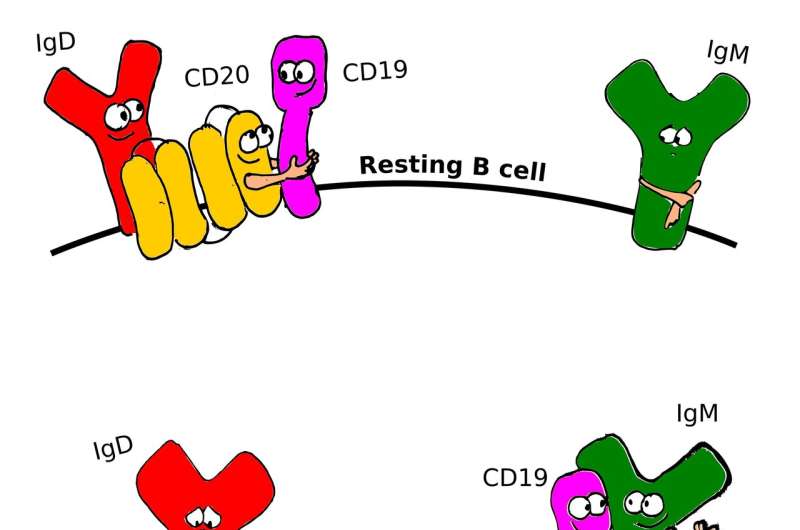
Rituximab是靶向膜蛋白CD20的抗癌药物,是对B肿瘤细胞的第一批准的治疗抗体。弗赖堡大学的免疫学家现在已经解决了一个关于它的工作原理的谜。由迈克尔·克雷什博士,使用细胞培养,健康细胞和来自癌症患者的细胞领导的团队研究CD20如何组织B细胞膜上的纳米结构。如果蛋白质缺失或rituximab与它结合,则B细胞表面的组织变化。在该过程中激活休息的B细胞。该团队已发表在期刊上的研究pnas.。
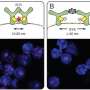
B.细胞是白血细胞和部分免疫系统。当他们认识到外国物质时,他们发展到血浆细胞。这些产生抗击细菌,病毒或肿瘤细胞的抗体。RETH的团队使用CRISPR / CAS9基因剪刀以除去肿瘤细胞系和健康B细胞中CD20的基因。然后研究人员在纳米级上分析了B细胞表面上的蛋白质的蛋白质与其他受体的新相互作用。“这些结果是基于我们对膜蛋白纳米蛋白的研究及其对免疫细胞调节的研究,”RETH说。
“蛋白质CD20保持IGM类和团体CD19的B细胞抗原受体。CD20从而确保B细胞的静止状态,”RESH解释。只有当这些蛋白质在膜内相互作用并形成IgM / CD19复合物 - 通常作为对外源性抗原的反应 - 是免疫细胞的防御完全活化。RETH的团队发现,这种复合物也在没有CD20的细胞中形成或用Rituximab治疗后形成。
Rituximab的结合,其针对B细胞淋巴瘤以及B细胞处方自身免疫疾病,向其他免疫细胞的信号以破坏所有CD20承载B细胞。这导致研究人员在用利妥昔单抗治疗期间检查患者的血液。“我们发现,B细胞表面上的Rituximab的CD20非常快速地消失了。然后这些B细胞保持未检测到,但通过CD20的缺失激活,”研究的第一个作者解释道。
因此,B细胞最终改变最终增殖并且可以发展成血浆细胞。这些等离子体细胞不再具有CD20,因此rituximab不再可接受。“在患有利妥昔单抗治疗的复发患者的血液试验中,我们还发现了增加量的血浆细胞,”Kläsener说。“到目前为止,目前尚不清楚蛋白质CD20的重要功能以及为什么有些患者用利妥昔单抗进行治疗后复发。现在我们理解为什么,”RECH解释道。“这有助于将来有助于发展更有效的疗法。”
进一步探索












用户评论