2021年2月4日,功能
吸毒不可驾驭的,不可能的新肺癌治疗目标
实体肿瘤的生长通常是由关键原癌基因的突变驱动的。对于非小细胞肺癌(NSCLC), KRAS (Kirsten RAt Sarcoma virus, Kirsten RAt Sarcoma virus)基因的体细胞突变将其转化为一种致癌基因,使肿瘤对常见化疗如厄洛替尼(特罗凯)或吉非替尼(易瑞沙)产生耐药性。
以前,KRA被认为是“不可驾拉的”,因为微小蛋白的表面没有用于药物相互作用的深袋,因为潜在的小分子抑制剂。由于许多NSCLC依赖于组成型激活的突变KRA,因此研究人员继续探索KRAS及其下游信号传导途径。该研究终于开始了。NSCLC肺癌的互补方法,统称在较大的KRAS生态系统的背景下具有完全看来的免疫自我防御。
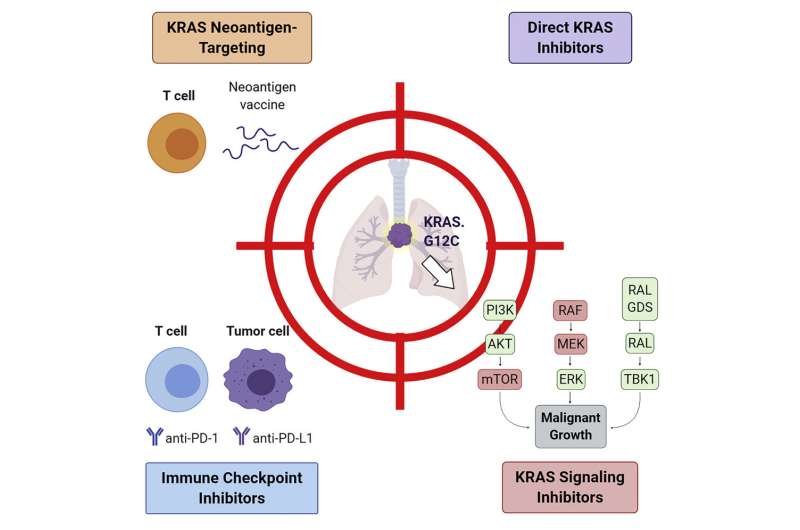
它们在一起,肉体肉体的肿瘤生物学的治疗微观可以复制和修饰,以作为治疗许多癌症类型的蓝图,每个癌症类型都是由自己独特的致癌司机持续的。在一篇文章中细胞报告医学研究人员概述了四种方式来打击KRAS依赖性NSCLC:免疫检查点抑制剂,KRA Neoantigen靶向,直接KRAS抑制剂和KRA信号抑制剂。
免疫检查点抑制剂(ICIS)已经是许多癌症的护理标准。PD-L1(编程的细胞死亡配体1)表达已与KRAS NSCLC细胞系和患者肿瘤组织的KRAS特异性改变有关。NSCLC肿瘤经常过表达PD-L1;因此,抗PD-1疗法,如pembrolizumab(Keytruda)可能是有益的单独或一起的常见变体KRAS抑制剂。例如,AMGEN的AMG510抑制剂(特定于G12C变体)促进促炎肿瘤微环境,当用ICIS给出时产生长期T细胞肿瘤反应。
KRAS突变,如G12C,可以产生新的表位,可以被免疫系统识别为外源蛋白。由于免疫系统从未被训练成只在癌细胞中发生突变的KRAS版本,它们将被视为应该被攻击的新抗原。问题是,当肿瘤被检测到时,免疫系统通常需要一点帮助。免疫治疗的目标是通过接种疫苗或通过过继T细胞治疗(细胞接受外部教育、扩大和重新引入)引起对这些新抗原的直接T细胞应答。Moderna Therapeutics和默克公司已经有针对KRAS G12C、G12D、G13D和G12V的mRNA癌症疫苗在试验中。该疫苗编码为单一RNA分子新抗原拼接体,应在HLA-A11:01和/或HLA-C∗08:02受体上呈现,以增强CD8+ T细胞反应。
我们在上面看过突变体KRAS的直接抑制剂可以有效,特别是当用ICIS提供时。主要好处是细胞非突变的,野生型KRAS不应受药物的影响,减少副作用。另一种对抗KRAS的策略是利用特定氨基酸侧链的法氨酰化定位于质膜的功能这一事实。不幸的是,法尼酰基转移酶抑制剂迄今为止在临床试验中产生了较差的结果。类似地,设计用来防止GTP-KRAS相互作用的小分子抑制剂也失败了,主要是因为GTP对KRAS的高亲和力。另外,泛kras抑制剂,如BBP-454 (BridgeBio Pharma)已经被开发出来,可以结合以前未识别的结合袋。另一种泛KRAS抑制剂BI 1701963,干扰KRAS与SOS1的结合,SOS1是激活KRAS所必需的鸟嘌呤核苷酸交换因子。
一些基因已经通过合成致死筛选鉴定,它们参与了NSCLC中的KRAS信号机制。这些包括罐结合激酶1 (TBK1),周期蛋白依赖性激酶4 (CDK4)和b细胞淋巴瘤特大号(BCL-XL)。用trametinib (MEK1/2抑制剂)或navitoclax (BCL-XL/BCL-2抑制剂)靶向表达它们,在异种移植模型中导致显著的细胞凋亡和肿瘤消退。KRAS信号也通过激活脂肪生成和ERK2激酶活性来诱导脂肪酸合成。在KRAS突变的肺腺癌细胞系中,用青褐素抑制脂肪酸合成酶显示细胞生长显著下降。
NSCLC患者对化疗的全部响应取决于除了KRAS之外的其他基因中的变体的存在。例如,涉及EGFR(表皮生长因子受体)突变的人对厄洛替尼具有60%的反应率。似乎在某种程度上,KRAS和EGFR的突变是互斥的。肺癌患者为kras突变,但不是egfr,化疗响应差。随着克拉斯的全突变景观现在迅速发光,有效的治疗可能涉及通过下游效应器的合成致死性靶向和间接靶向的直接KRA的组合方法。当两种或多种基因表达中的缺陷组合导致细胞死亡时,产生合成致死性,而这些基因中只有一个的缺乏症则没有。突变,表观遗传变化和抑制剂都可以创造缺乏条件。
©2021科学欧宝app网彩X网络













用户评论