研究人员发现SARS-COV-2穗蛋白的潜在新的治疗目标
Covid-19大流行促使SARS-COV-2穗蛋白在感染过程中如何对人细胞附着的大大调查,因为这种知识可用于设计疫苗和治疗剂。现在,一支科学家团队已经发现了穗蛋白质的额外位置,不仅有助于解释某些突变如何使新出现的变体更为传染性,而且可以用作治疗干预的额外目标。
“正在进行重大的研究以检验在球杆状SARS-COV-2尖尖处的受体结合结构域(RBD)是如何蛋白质附在一个ACE2受体上人类细胞但是,由于这种附件,尖峰蛋白中发生的其他变化很少,“宾夕法尼亚州化学副教授的Ganesh Anand,”化学副教授“,”我们已经发现了“热点”的尖峰蛋白对于SARS-COV-2感染至关重要,可能是超越RBD的新型目标,用于治疗干预。“
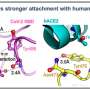
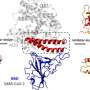
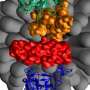
Anand和他的同事使用了一个称为酰胺氢 - 氘交换的过程质谱(HDXMS),可视化SARS-COV-2穗蛋白与ACE2受体结合时会发生什么。HDXMS使用重水或氧化氘(D2O),是由重氢或氘形成的天然存在的非放射性同位素,作为用于测绘蛋白质的探针。在这种情况下,团队将SARS-COV-2穗蛋白和ACE2放置受体在重水并获得了穗蛋白质的ACE2的脚印。
“如果将尖峰蛋白和ACE2受体纳入用D2O制成的溶液中,则与其内部相比,两种蛋白质上的表面和更多的软盘区域将更加交换氘的氢,”Anand。“含有结合伴侣上的每种蛋白质的占地面积可以容易地从您看到小氘的区域识别,并且只检测正常氢气。”
使用这种技术,该团队确定了穗状蛋白和ACE2受体的结合对于Furin样蛋白酶 - 一种人酶的家族 - 一种人酶 - 即尖端,称为S1亚基的尖端,其是病毒对细胞感染的下一步。该调查结果于2月8日在杂志中发表el。
“病毒表面上的尖峰蛋白旋转以搜索和锁定在ACE2受体上,”Anand。“ACE2可以被比作一只手握住头发的股线 - 穗蛋白质簇。与尖刺稳定的束缚,使其可以通过Furin蛋白酶剪刀切割。弗林蛋白蛋白酶夹蛋白质后,剩下的部分 - S2亚基 - S2亚基什么融合细胞膜,允许进入细胞。“
Anand指出,研究人员已经了解了尖刺蛋白和ACE2受体如何结合在一起,但直到现在,没有人知道这种结合如何将该消息转移到Furins以切割蛋白质。他解释说,这种现象称为七星世,意思是“距离的行动”。
“我们的研究结果显示了与SARS-COV-2刺激蛋白结合的Ace2受体引起的远程变化,并模拟增强在远端S1 / S2切割位点上的蛋白酶切割,”他说。
Anand表示,研究人员目前仅关注治疗刺激蛋白与ACE2受体结合的治疗剂。
“在本文中,我们建议这不是唯一可以瞄准的漏洞,”他说。“也许Furin切割所需的S1 / S2裂解可以作为对病毒抑制治疗药物的新靶标。该研究还可以帮助解释新出现的变体中的突变如何改变ACE2结合的动态和构型,可能增加的传染性SARS-COV-2病毒。“
进一步探索















用户评论