结合家族史和基因组筛查提供了评估癌症风险的最佳方法
临床医生历史上使用家庭健康历史收集作为识别可操作疾病风险评估的主要方法。然而,随着大规模的基因组筛查计划的流行程度持续上升,科学界已经质疑这种传统方法的功效,想知道通过在识别这些风险时测序素质卫生史的测序确定的变体的优越性。
为了解决这个问题,杜克应用基因组学和精准医学中心(CAGPM)最近与新加坡国立大学(NUS)精准医学研究所(PRISM)合作,评估如何进行家庭健康历史可以与基因组测序最佳协同。他们的研究结果最近发表在基因组医学。
在这项研究中,CAGPM的教职工Geoffrey Ginsburg,医学博士,医学教授(心脏病学),Lori Orlando,医学博士,医学副教授(普通内科),Ryanne Wu,医学博士,医学助理教授(普通内科)和PRISM团队发现了整合先发制人的家庭健康历史除了基因组筛选外,收集结果还增加了检测癌症综合症携带者的可能性。
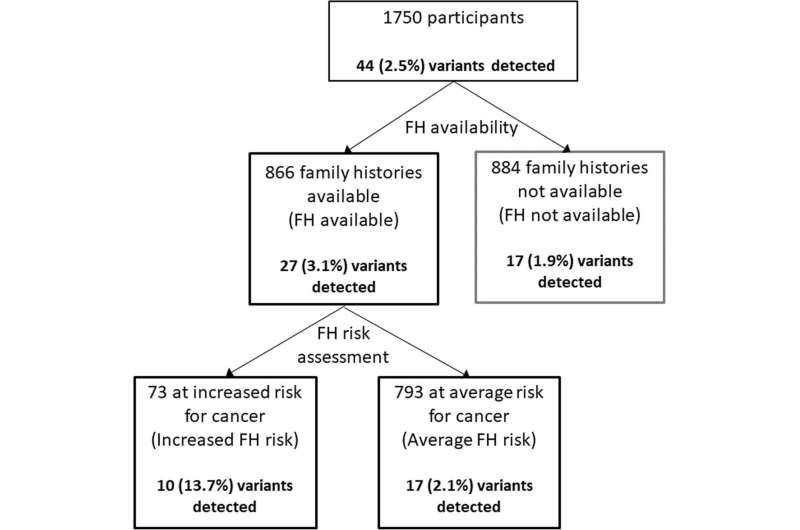
这项在新加坡进行的研究包括了1750名没有已知的既存状况的参与者医疗条件他们同意通过棱镜计划进行医学和基因筛查
金斯伯格博士说:“这项研究不仅显示了家族史对东南亚不同人群的影响,而且显示了它在优化风险评估中优先考虑基因组测序的力量。”
PRISM缺乏一种全面收集家庭健康史的机制,而CAGPM的MeTree是一种为此目的而设计的在线工具,它为科学数据收集提供了足够彻底的途径,但也为患者提供了足够方便的使用。
研究发现,在收集的866名家族病史患者中,73人被认为有患癌症的风险,七分之一的人有显性的临床可操作变异。在793名被认为没有癌症风险增加的人群中,47人有1人患癌症的风险增加了6倍;在没有家庭健康史的人群中,52人有1人患癌症的风险增加了7倍。当只评估美国医学遗传学学院(ACMG)的次要发现列表中的25个癌症基因时,那些有显著家族健康史的人与那些没有显著家族健康史的人相比,有致病变异的可能性是前者的18倍。
63名有明显家庭健康史的参与者没有发现有致病变异。
奥兰多博士列举了几个原因,解释为什么基因组健康筛查可能会遗漏由家庭健康确定的风险。因此,当共同的环境是一种疾病风险的唯一或主要因素时,你不能仅仅通过基因测试来发现它,”奥兰多说。基因组学是一个快速发展的领域,我们还有很多要学习。一个家族可能有一种尚未被科学确定的致病变异。”
对于临床医生来说,在讨论发现致病变异的可能性时,家庭健康史的实施有助于指导患者的预期。经检测,家族史资料加上基因型可为患者提供更准确的疾病外显率指征。
“这项研究告诉我们的是家庭健康史仍然是鉴别最可能有患遗传性癌症综合征风险的人群的重要一线筛查工具,”吴博士说。
这一领域的研究,以及杜克-新加坡国立大学和CAGPM之间的合作,才刚刚开始。研究人员打算将研究范围扩大到全球范围内更大、更多样化的人群,并关注服务不足的社区,这些社区往往没有足够的资源主动应对其健康风险。
进一步探索











用户评论