全息显微镜照亮神经元网络活动的疼痛驱动变化
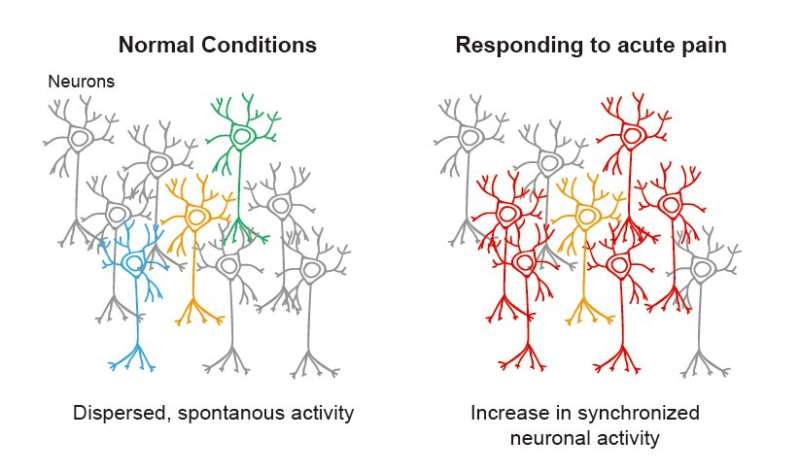
一项跨机构的研究合作使用了钙成像和全息刺激相结合的双光子显微镜,揭示了位于初级躯体感觉皮层的神经元之间的功能连接在急性疼痛的反应中增加,这在世界上是首次。
疼痛是损伤的结果,如外周神经元损伤或外周组织损伤引起的炎症。关于中枢神经系统异常在疼痛发作和持续疼痛中的作用的研究结果已经发表。大脑皮层的初级躯体感觉皮层在识别疼痛的强度和位置方面起着重要的作用。使用功能核磁共振成像和双光子显微镜进行的研究表明,当这种情况发生时,大脑的这部分活动会加速剧烈的疼痛经验丰富。然而,尚未揭示神经元之间的功能性连接和同步如何随时间变化,以及这些改变对疼痛的影响。
研究人员使用炎性疼痛模型小鼠进行了实验,结果表明,在急性疼痛期间,神经元群的自发活性和神经元中神经元之间的同步活性增加。此外,他们发现当用全息光刺激单个神经元时,从周围的神经元响应增加。随着疼痛的改善,神经元逐渐恢复到原始状态。研究人员还表明,n型钙离子通道中的表达水平涉及该机制,揭示当施用阻断这些通道的抑制剂时可以恢复疼痛阈值。希望这些发现可以促进慢性疼痛患者的治疗方法。
这些研究结果将出版科学的进步2021年3月19日。
研究背景
疼痛是损伤的结果,如外周神经元损伤或外周组织损伤引起的炎症。每个人都经历过一个不可避免的感觉,但发病和痛苦的疾病的详细机制尚未被阐明。进行了对疼痛的重要研究,专注于脊髓背角中神经元和神经胶质细胞的激活。随着成像技术的发展,近年来大脑疼痛与地区之间的关系增加了研究。
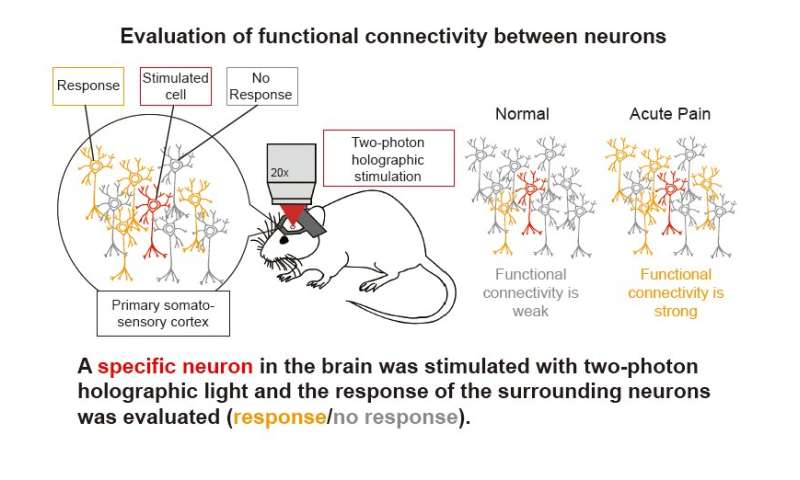
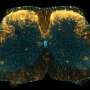
这大脑皮层初级躯体感觉皮质(S1)是大脑的一个区域,在区分痛苦中起着重要作用。使用诸如FMRI和双光子显微镜等成像技术进行的研究表明,在急性疼痛期间S1中的神经元群加剧;然而,涉及产生和维持疼痛的S1中的详细,底层神经网络尚未阐明。
研究团队使用双光子显微镜进行钙成像以跟踪鉴定的神经元,在急性疼痛期间,在S1神经元之间的自发神经元活性和同步的升高。此外,他们透露,当用全息光刺激单个神经元时,来自周围神经元的反应增加,随着疼痛改善,神经元逐渐返回其原始状态。此外,发现N型钙离子通道的表达在该机制中起作用,研究人员表明,当纠正该表达时,可以有效地恢复疼痛阈值。
研究方法及成果
研究人员使用双光子显微镜进行钙成像。该方法使它们能够监测活大脑中神经元的活动。通过将完全弗氏佐剂(CFA)注入后爪来开发炎症疼痛模型小鼠。在急性疼痛期间,2/3 S1层中神经元的自发性活性增加,神经元之间的同步如此。该研究组还表明,一旦疼痛改善,神经元返回其原始状态。此外,他们发现神经元之间的同步水平越高,疼痛阈值越低。
为了验证上述结果,我们采用双光子显微镜钙成像和全息刺激相结合的方法进行了实验。研究发现,当炎症疼痛模型小鼠的单个S1神经元受到刺激时,急性疼痛期间来自周围神经元的反应增加。相反,当疼痛减轻时,周围神经元的反应就会减少。综上所述,研究表明,在急性疼痛期间,由于S1神经元之间的功能连通性增强,神经元之间的同步性增强,而当这种疼痛得到改善时,这种同步性减弱。
为了验证S1 2/3层中神经元的增加自发性活性与疼痛的阈值之间的关系,通过氯氮平-N-氧化物(CNO)激活的改性人毒蕈碱受体(HM3DQ)人为地诱导增加的神经元小鼠S1中的活性。然后研究人员比较了CNO给药前后小鼠的神经元活性和疼痛阈值(使用越野)。这些结果表明,当在小鼠中人工诱导S1神经元活动时,神经元之间的同步增加,而疼痛阈值降低。
流式细胞术用于研究与这些结果有关的分子机制。这表达水平在炎症疼痛模型小鼠的S1神经元中的每个离子通道与未暴露于疼痛的野生型小鼠的炎症疼痛模型小鼠。结果表明,在炎性疼痛模型小鼠中,N型钙通道中的表达增加,并且通过施用钙通道抑制剂(作为静脉内注射,或在S1的表面上作为软膏),疼痛可以恢复阈值。
进一步的研究
这原发性躯体卷曲皮质(S1)是大脑的一个区域,在区分疼痛中起着重要的作用,到目前为止的研究表明,当急性疼痛发生时,S1中的神经元群活动会加速。目前的研究表明,这种活动不仅在对急性疼痛作出反应时加速,而且还增加了神经元之间的功能连通性和同步活动。
接下来,研究小组将利用全息刺激来检验神经元活动和疼痛之间的因果关系。他们将首先识别和确定在疼痛中发挥重要作用的S1神经元的特征,然后对识别出的细胞应用全息刺激来研究因果关系。此外,研究人员计划研究急性心肌梗死的可能治疗方案疼痛,例如防止增加功能之间的连接神经元。
进一步探索














用户评论