蛋白质组学分析确定了侵袭性人类癌症的潜在药物靶点
 Monsivais, et al/Oncogene, 2021" width="768" height="406">
Monsivais, et al/Oncogene, 2021" width="768" height="406">
贝勒医学院的研究人员表示,对侵袭性人类癌症的蛋白质组学或所有蛋白质数据的分析是识别潜在的新治疗靶点的有用方法。他们在杂志上发表了报告致癌基因,鉴定与研究的七种癌症类型中的每种侵蚀性疾病的临床测量相关的“蛋白质组学签名”。在不同类型的癌症之间共享一些签名,包括改变代谢的细胞途径。重要的是,实验结果提供了概念证明,其蛋白质组学分析方法是识别潜在治疗目标的有价值的策略。
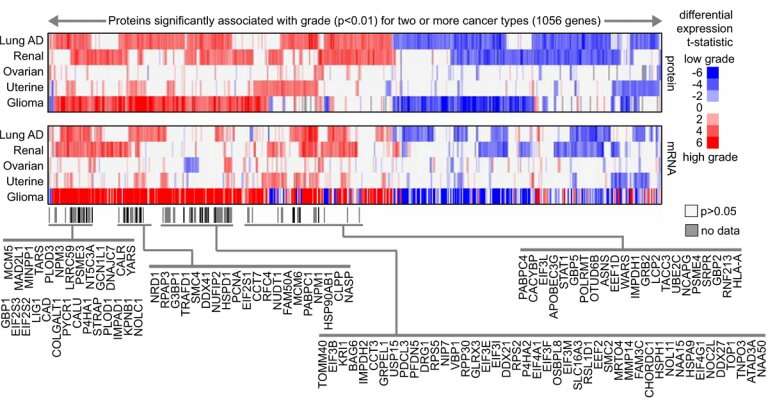
“这项研究有两个值得注意的方面。一个是我们探索了蛋白质组学景观癌症共同通讯作者Chad Creighton博士说,他是医学教授,也是贝勒的Dan L Duncan综合癌症中心的癌症生物信息学联合主任。“我们分析了蛋白质数据,其中包括来自约800种肿瘤的数万种蛋白质,其中包括7种不同的癌症- 用临床蛋白质组学肿瘤分析联盟(CPTAC)质谱蛋白质组学数据集提供的面糊,结肠,肺,肾,卵巢,子宫和儿科胶质瘤 - 制造。“
CPTAC数据集的计算分析鉴定了与癌症癌症相关的蛋白质组学签名。这些签名指向可能是促进侵袭性癌症行为的改变的细胞途径,并且可以代表新的治疗目标。每种癌症类型都显示出一种独特的蛋白质组学签名为了它的侵略性形式。有趣的是,某些签名对不同类型的癌症是常见的。
这项研究的另一个方面是提供概念证明,蛋白质组分析是一个有用的策略,以确定侵袭性疾病的驱动因素,可以操纵潜在的控制癌症生长。
“这正是我们能够与这个新的,非常强大的数据集做些什么,”贝勒的病理学和免疫学助理教授Diana Monsivais博士说。“我们专注于子宫癌数据,其中计算分析鉴定了与侵略性癌症相关的许多蛋白质中的改变。我们选择了蛋白激酶,将代表更强的治疗候选者的酶。”
研究人员在数百个初始候选人中选择了四个激酶,用于子宫癌细胞中的功能性研究。他们发现不仅在子宫癌细胞中表达的激酶,而且还可以在操纵一些激酶的表达降低存活或迁移一些子宫癌细胞的能力。细胞迁移是癌细胞的性质,其允许它们将癌症扩散到其他组织。
这项工作是两个贝勒中心,Dan L Duncan综合癌症中心和药物发现中心之间的生产合作的结果。
“查德对新的CPTAC数据集进行了精彩的分析,并对在人类癌症中验证它感兴趣。他要求我们进行功能研究,以确定某些蛋白质是否可以转化为子宫内膜癌的新靶点。”“我们的实验为蛋白质组学提供了概念证明分析是一种有用的策略,不仅能更好地理解癌症的成因,还能找到控制或消除癌症的新方法。”
“历史上,研究人员只会产生转录组数据(转化为蛋白质的信使RNA(mRNA))。看着由CPTAC提供的蛋白质数据本身使研究人员能够从这些中提取新的信息层癌症,“Creighton说。“在这项研究中,我们比较了mRNA和蛋白质签名,虽然在许多情况下,它们重叠,大约有一半的蛋白质蛋白质组学签名未包含在相应的mRNA签名中,表明需要包括mRNA和蛋白质癌症研究的数据。”
进一步探索









用户评论