科学家们开发新的platelet-based配方结合抗癌药物治疗
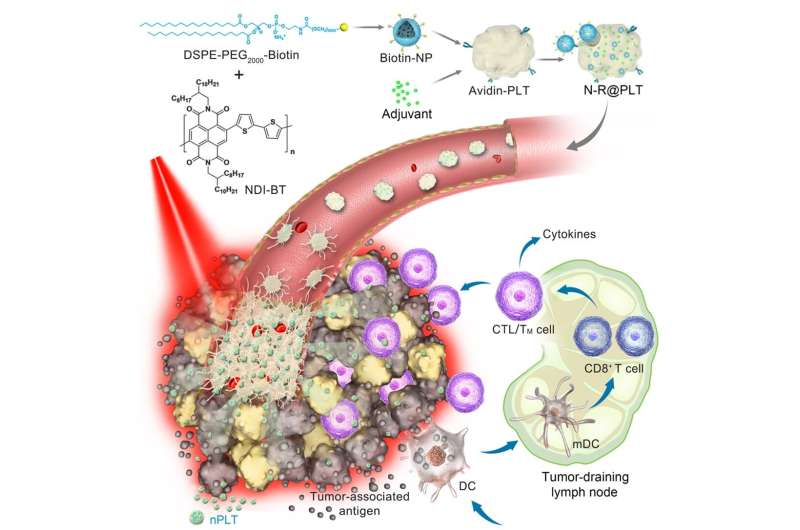
肿瘤靶向和瘤内渗透为癌症治疗是长期存在的问题。
过程工程研究所的研究人员(IPE)中国科学院和中国科学院大学的(UCAS)已经开发出一种新的platelet-based制定了有效的治疗效果与癌症的小鼠模型。
科学家们利用血小板的聚集和激活特性来解决的问题肿瘤目标和瘤内渗透。在光热光谱分析纳米颗粒和immunostimulators,这种仿生配方也实现了一个高效的联合治疗对多种类型的癌症。
这项研究发表在科学的进步3月26日。
最近,光照疗法(PTT)吸引了越来越多的关注。虽然有前途的,高效的交付PTT仍面临一系列的问题。敏化的积累,特别是在肿瘤站点,和随后的瘤内渗透限制对于大多数抗癌疗法,因为癌症的异质性和紧凑的细胞外基质。
作为一种新型的交付向量,血小板肿瘤网站显示他们交付货物的能力通过几种机制,建议他们合理候选肿瘤靶向和瘤内渗透。
高温可以诱发肿瘤细胞释放的抗原。这样的反应不仅揭示了内在关系的潜在机制PTT和immunoactivation,但也鼓励PTT和免疫疗法改善抗癌治疗。
在这个新的platelet-based配方,光热光谱分析纳米颗粒和immunostimulators简单,温和有效地集成到血小板。
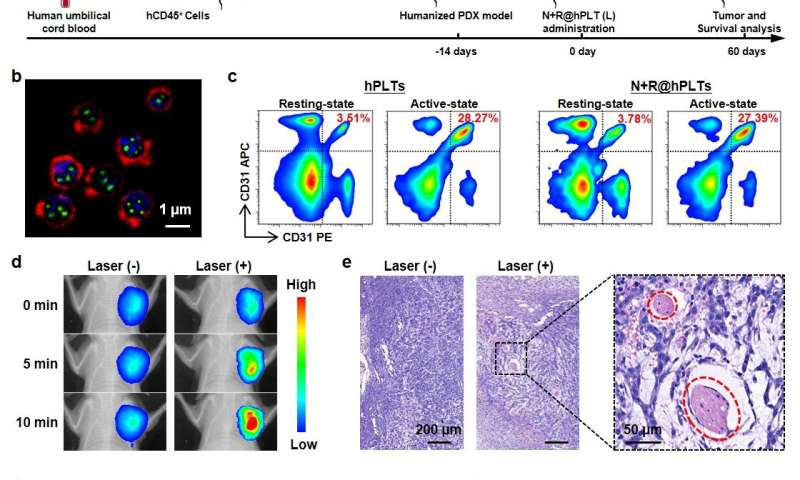
“光热光谱分析这部小说光热光谱分析纳米粒子的转换效率达到69.2%。因此,低功耗,附近红外线(NIR)辐照可以产生足够的当地的高热,“田教授说从UCAS志远。
仿生的血小板是血液中的循环哨兵和有敏感反应血管损伤。因此,他们充当先头部队的一部分'在有缺陷的肿瘤血管内皮细胞粘附。
与低功耗近红外光谱辐照后,当地高热导致急性血管损伤,随后诱导增强血小板的聚合级联形成一个针对阿森纳原位。
随后,纳米尺度的proplatelets (nPLTs)进一步对这些激活血小板生成。“我们观察到nPLTs传递货物进入肿瘤组织,扩大该地区的攻击,“从IPE魏魏教授说。
光照引起的肿瘤消融治疗后,immunostimulator增强释放肿瘤相关抗原的免疫原性,进一步诱导人体的免疫反应攻击残留,转移和复发性肿瘤。
研究证明有效的治疗效果低功耗近红外光谱辐照在9个不同的小鼠模型,最值得注意的是,一个复杂的模型基于人类血小板,人性化的小鼠和patient-derived肿瘤异种移植(PDX)。
“这些结果显示了这部小说利用仿生的巨大希望血小板平台在高性能和抗癌疗法相结合,”马教授说从IPE广绘。
的同行审查科学的进步说这项研究是组织和执行。”The reviewer also emphasized that "this system is very effective in tumor治疗和已被证明在不同的肿瘤模型,我非常想看这个工作转化为临床应用”。
进一步探索











用户评论