Sturdier Spike蛋白解释了冠状病毒变异的速度更快
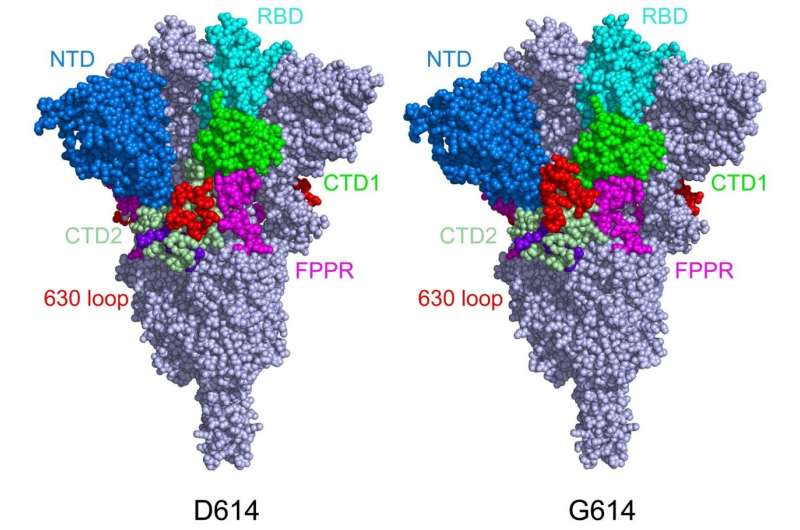
快速蔓延的英国,南非和巴西冠状病毒变体正在提高关于Covid-19疫苗是否会保护其的担忧和问题。Bing Chen LeD的新工作,在波士顿儿童医院分析了冠状病毒穗状体蛋白的结构如何随着所有三种变体携带的D614G突变 - 并且显示为什么这些变体能够更快地扩散。该团队报告了其调查结果科学(3月16日,2021年)。
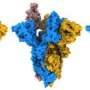
Chen的团队用冷冻电子显微镜(Cryo-Em)成像尖峰,该尖峰与原子水平有决心。他们发现D614G突变(替代A单氨基酸“信”在遗传密码对于斯派克蛋白质)与原始SARS-COV-2相比,使刺激更稳定病毒。结果,更多的功能尖峰可用于与我们的细胞的ACE2受体结合,使病毒更加感染。
防止尖峰的形状变化
在原始的冠状病毒中,尖峰蛋白将与ACE2受体结合,然后显着改变形状,折叠自身。这使病毒能够用自己的细胞的膜熔化膜并进入内部。然而,正如陈和同事于2020年7月报告的那样,尖峰有时会过早地改变形状并在病毒与细胞结合之前分开。虽然这种病毒减慢了,但这种形状变化也使我们的免疫系统含有含有病毒的变化。
“因为原始的尖峰蛋白质会使,它不足以诱导强烈的中和抗体反应,”陈说。
当陈和同事成像突变穗蛋白时,他们发现D614G突变通过阻挡过早而稳定钉子形状变化。有趣的是,突变也使得穗状花序对ACE受体更弱,但是尖峰较少易于崩溃的事实过早地使病毒变得更加感染。
“说原来的病毒有100个尖峰,”陈解释道。“由于形状不稳定,您可能只有50%的功能。在G614变体中,您可能有90%的功能,因此即使他们也没有结合,您将更大的机会感染。”
陈提出重新设计的疫苗纳入该突变穗蛋白的代码。他说,更稳定的尖峰形状应制造基于尖峰的任何疫苗(如现代人,辉瑞和约翰逊疫苗)更有可能引发防护中和抗体。
未来方向:一种药物阻止冠状病毒进入
陈和他的同事进一步申请结构生物学为了更好地了解SARS-COV-2如何与ACE2受体结合,眼睛朝向治疗剂抑制病毒,从而从而进入我们的细胞。
1月份,该团队在自然结构和分子生物学上显示,结构化工程化的“诱饵”ACE2蛋白与身体自身的ACE2强烈地结合了病毒200倍。诱饵效果抑制了细胞培养中的病毒,表明它可能是抗Covid-19治疗。陈现在计划将这项研究推进动物模型。
进一步探索












用户评论