伴侣蛋白失衡会促进老化大脑中有毒tau蛋白的积累
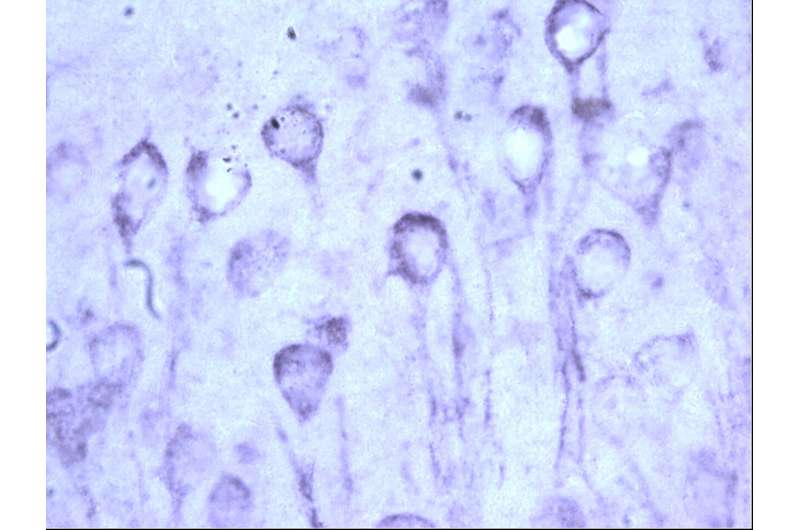
南佛罗里达健康大学(USF健康)神经科学家的一项新的临床前研究表明,伴侣蛋白失衡可能在衰老大脑中开始tau蛋白的毒性积累中起着重要作用——这是阿尔茨海默病和相关神经退行性疾病(称为tau病)发展的早期步骤。
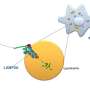
在人体中,tau蛋白的错误折叠导致其有毒物质在体内积聚大脑细胞,这些tau蛋白聚集形成神经纤维缠结,神经元死亡,并最终出现认知能力下降的症状,如记忆丧失思维能力下降。
在这项研究中,USF Health Morsani医学院的研究人员使用非转基因小鼠(野生型小鼠)来检查Aha1和FKBP52这两种共同基因的影响伴护热休克蛋白Hsp90的蛋白质他们通过在这些老年宽型小鼠中过表达Aha1和FKBP52来模拟分子伴侣失衡。这些发现在4月8日的《神经病理学通讯学报》上发表。
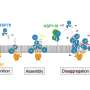
热休克蛋白90是一种伴侣蛋白,大量存在于大脑中的神经元和其他细胞中。通常,辅伴侣蛋白协助伴侣蛋白监测和维持对细胞健康至关重要的蛋白质的平衡(内稳态)。
“伴侣蛋白网络是你的细胞在一生中维持内稳态的天然防御,这项研究强调了在衰老的大脑中保护这种平衡的重要性,”首席研究员Laura Blair博士说,她是USF健康伯德阿尔茨海默症中心的分子医学助理教授,Morsani医学院。“我们很高兴使用这种新的牛皮病模型来寻找恢复伴侣蛋白平衡的方法,以延迟或阻止阿尔茨海默氏症和其他神经退行性疾病的进展。”
在众多质量控制功能中,伴侣蛋白网络确保蛋白质被折叠以符合适当的3D形状,精确地运输到需要它们工作的地方,并在它们被异常修饰或不再有用时将其推向降解。像Hsp90这样的热休克蛋白,在细胞处于应激状态时被触发,在纠正蛋白质错误折叠以防止聚集方面发挥着特别重要的“分类”作用。
“但在衰老的大脑在这种情况下,伴侣蛋白的平衡发生了变化,导致系统的工作效率不像正常情况下那么高。大量伴侣分子的表达减少,而少量但显著的表达增加,”布莱尔博士说。
年龄增长是老年痴呆症已知的最大风险因素。因此,USF健康团队研究了FKBP52和Aha1水平的单独增加是否会在老年野生型小鼠中引发模拟人类阿尔茨海默病的病理特征——没有基因操纵的野生型小鼠易使其大脑tau蛋白聚集异常增加。
他们的新小鼠模型的主要发现包括:
- 在老年野生型小鼠中,高水平的FKBP52和较低程度的Aha1水平增加了tau蛋白的积累。
- 过度表达FKBP52促进tau蛋白的积累,而不是Aha1,通过夸大激活神经支持细胞,即小胶质细胞和星形胶质细胞,与增加的神经炎症相关。这与神经元的丧失和认知障碍相辅相成。
现有的小鼠模型,包括那些增加或减少基因,引入tau蛋白突变,以及在小鼠大脑中植入人类tau蛋白的模型,帮助科学家更多地了解阿尔茨海默病和其他tau病的潜在原因。然而,它们往往在捕捉神经退行性变的生理方面在正常和异常衰老的背景下受到限制。
“我们希望这个(伴侣失衡)模型将帮助我们更好地理解tau蛋白聚集和神经炎症的动力学,包括病理事件之间的时间和联系,而不直接调节一个或另一个通路,”布莱尔博士说。
布莱尔博士的团队设计了后续研究,以帮助弄清楚tau蛋白积累或神经炎症是否以及何时对病因更有影响大脑衰老过程中的细胞毒性。这可以帮助确定哪些伴侣- fkbp52, Aha1或其他-可能是恢复的最佳治疗靶点选择蛋白质平衡,她说。













用户评论