美普林β酶抑制,与阿尔茨海默病的发展相关,分析
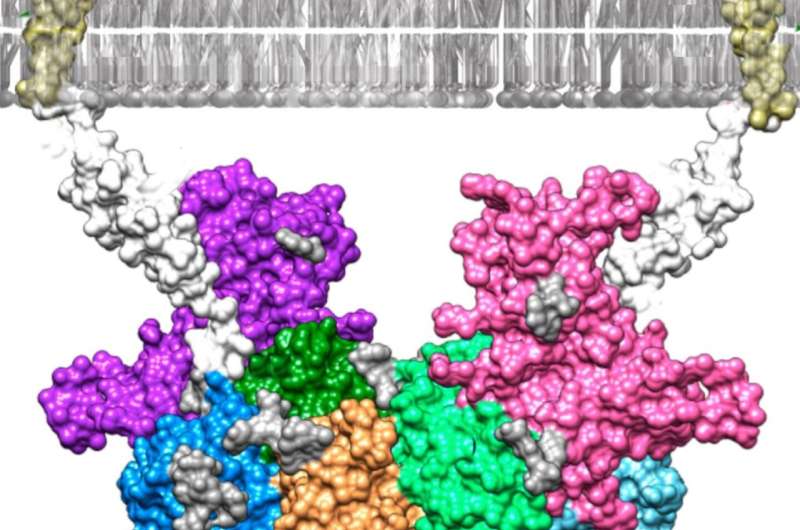
德国美因茨约翰内斯古滕贝格大学(JGU)和西班牙巴塞罗那分子生物学研究所的研究人员发现了血浆蛋白fetuin-B如何与酶meprin β结合,并使用计算机模型可视化他们的发现。这些研究结果可能有助于开发新的药物来治疗阿尔茨海默氏症和癌症等严重疾病。Meprin β从细胞膜中释放蛋白质,从而控制人体的重要生理功能。然而,这一过程的失调会引发老年痴呆症和癌症的发展。Meprin β是由fetuin-B在需要时结合到酶的调节,从而阻止其他蛋白质的释放。在杂志上展示他们的发现美国国家科学院院刊研究人员现在是第一个详细描述这种结合的人。
美因茨大学的研究小组在昆虫细胞中产生了meprin β和fetuin-B,然后让它们在试管中相互反应。通过测量酶通过动力学和生物物理分析,研究人员确定该反应产生了一个异常稳定的、高分子质量的复合物。他们在巴塞罗那的同事随后利用x射线晶体学成功地将复合物结晶,并确定了其三维结构。这涉及x射线被发射到蛋白质这使得晶体的原子结构可以通过x射线的衍射计算出来。一个计算机模型然后生成结构的。
“多亏了这个模型,我们现在可以确切地看到meprin β和胎儿球蛋白b是如何结合在一起的,”Walter教授Stöcker说,他与Hagen博士Körschgen和Nele von Wiegen一起在JGU进行了这项研究。“这项研究为我们更好地了解阿尔茨海默氏症等疾病,以及开发对抗这些疾病的药物提供了一个很好的起点。”已知Meprin β参与了所谓的β -淀粉样斑块的形成,这是该疾病的特征。此外,阿尔茨海默氏症患者的血液中胎儿- b相对较少,这反过来可能导致meprin β调控的缺失。Stöcker总结道:“如果有可能开发出一种能与这种酶结合并以类似于胎儿b的方式抑制它的药物,这可能成为治疗老年痴呆症的一种新方法。”
进一步探索













用户评论