发现蛋白质控制正常生长和癌症的驱动因素
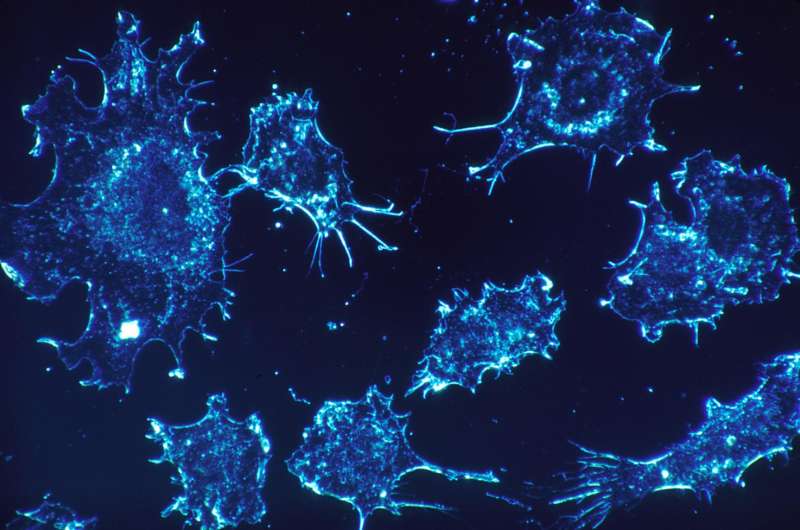
研究人员发现了一种长寻求的酶,可以通过使蛋白质的崩溃能够脱节细胞生长,并且在禁用时导致癌症。
发布在网上自然4月14日,新的研究围绕着每个人类细胞一分为二的能力展开单个细胞(受精卵)成为万亿细胞的身体。对于每个分裂,细胞必须遵循某些步骤,其中大部分是由称为细胞周期蛋白的蛋白质促进的。
由纽约大学格罗斯曼医学院(Grossman School of Medicine)的研究人员领导的这项研究揭示了一种名为AMBRA1的酶标记了一种关键的细胞周期蛋白,这种细胞周期蛋白可以被分解蛋白质的细胞机器所破坏。这项研究发现,这种酶对细胞周期蛋白的控制对于胚胎发育过程中细胞的正常生长至关重要,而这种酶的功能失常会导致致命的细胞过度生长。此外,该研究进一步表明,现有的药物类别可能能够在未来扭转这种缺陷。
如在发展中的胎儿中,细胞分裂的限制是预防异常,癌症中腐蚀性生长的核心,新的研究发现细胞已经进化以使用Ambra1防御它。
“我们的研究阐明了人类细胞的基本特征,提供了见解癌症生物学并开启新的研究途径进入潜在的治疗方法,“Nyu Langone Health的生物化学和分子药理学系的主席,MICHELE Pagano,MICH,以及与Howard Hughes Medical Institute的调查员。
新肿瘤抑制器
目前的研究解决了三种D型细胞环素,该子集必须与称为细胞周期蛋白依赖性激酶(CDK),特别是CDK4和CDK6的酶联的子集,如果细胞要分开。作者发现Ambra1作为连接酶,将分子标签附着到所有三个D型结构周期,标记它们以进行破坏。先前提出了由科学界被细胞消除D型细胞周期素的机制。因此,在新研究之前,Pagano说,在新研究之前,D型周期素的中央调节器仍然难以难以捉摸。
这项新研究还揭示了AMBRA1在生物发展中的作用。缺乏AMBRA1基因(AMBRA1酶的编码基因)的老鼠,产生了不受控制的、致命的组织生长,扭曲了发育中的大脑和脊髓。研究人员还首次发现,用CDK4/6抑制剂治疗携带没有AMBRA1基因胚胎的怀孕小鼠,减少了这些神经元异常。
而言,癌症,作者分析了患者数据库以得出结论,ambra1低于正常表达的人不太可能存活弥漫性大B细胞淋巴瘤,这是美国的非霍奇金淋巴瘤的最常见形式。Ambra1的较低表达的原因可以包括删除基因的随机变化或使其编码指令更难读取。
为了确认Ambra1作为肿瘤抑制的作用,研究人员在宾夕法尼亚州的研究作者Luca Busino,Ph.D中监测了弥漫性大B细胞淋巴瘤的小鼠模型中的癌细胞生长。人类B细胞淋巴瘤细胞例如,不携带AMBRA1基因的肿瘤比携带该基因的肿瘤生长速度快三倍。纽约大学朗格尼领导的研究着眼于弥漫性大b细胞淋巴瘤,斯坦福大学和丹麦癌症协会研究中心领导的另外两项研究发表在同一杂志上自然研究发现,AMBRA1缺失或缺失是导致肺癌的关键因素。
此外,已知d型细胞周期蛋白与CDK4和CDK6组装成鼓励正常和异常的酶细胞生长。抑制CDK4和CDK6的药物近年来已被FDA批准作为癌症疗法,但有些患者对药物的反应较弱。提供对这个问题的洞察力,目前的团队发现缺乏Ambra1的淋巴瘤对CDK4 / 6抑制剂敏感。当缺少Ambra1基因时,D型微型蛋白的水平变高,以与另一CDK(CDK2)形成复合物,由于其结构,不能通过CDK4 / 6抑制剂灭活。
“这使得AMBRA1成为选择最适合CDK4/6抑制剂治疗的患者的潜在标记物,”第一作者Daniele Simoneschi博士说,他是纽约大学朗格尼健康中心生物化学和分子药理学高级研究协调员。下一步,他说,研究小组计划研究CDK4/6抑制剂和CDK2抑制剂在低AMBRA1肿瘤中的作用,以及那些d型细胞周期蛋白突变使其对AMBRA1不敏感的肿瘤。
进一步探索













用户评论