研究人员发现了特异性癌症治疗的新疗法靶标

西奈山医学院的研究人员发现了一种肿瘤细胞利用选择性自噬进行代谢重编程的机制,这有利于肿瘤细胞生长,并提供了对葡萄糖剥夺的抵抗力。该研究表明,akap220介导的自噬作为特异性癌症治疗的新靶点。
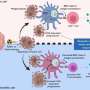
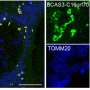
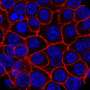
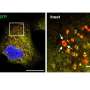
自噬是一种溶酶体降解途径,通过循环细胞内货物和供应分解产物来保护细胞。研究人员现在展示了一种新的机制自噬选择性地降解PKA抑制亚基RIA,其通过Akap11受体介导的能量危机介导。AKAP11介导的RIA和CAMP / PKA活化的降解导致线粒体的提高代谢对葡萄糖饥饿的反应以及随后对细胞存活的保护。重要的是,他们显示了AKAP11水平的抑制肿瘤细胞抑制RIa的降解,阻断PKA的活化,从而抑制肿瘤细胞的生长。
该研究表明,通过不禁止蛋白激酶A(PKA),细胞代谢母代谢,促进线粒体代谢再次挤出的蛋白激酶保护和肿瘤生长的新概念。多条证据表明PKA在肿瘤中的激活和PKA驱动肿瘤发生的激活。这些研究通过阻断自噬介导的PKA活化来揭示一种新的治疗靶标在治疗某些癌症。
该研究揭示了一种细胞保护机制,从而对细胞补充和存活的消化营养素的产生,自噬控制细胞代谢。作者鉴定了自噬在促进营地/ PKA,细胞代谢常规调节剂的活动方面的关键作用,以保持能量危机期间的细胞生存。他们表明自噬选择性地降解PKA抑制亚基Riα,其通过Akap11受体介导。AKAP11介导的阵营/ PKA活化导致对葡萄糖饥饿和随后的细胞存活的保护,导致线粒体代谢提高。他们还表明肿瘤抑制肿瘤中的AKAP11水平细胞防止Riα的降解并因此阻断PKA活化,因此导致肿瘤细胞生长的抑制。他们得出结论肿瘤细胞利用选择性自噬降解AKAP11并激活PKA以获得它们的生长和对葡萄糖剥夺的抵抗力。“
Sinai山振宇博士的研究:“我们的结果通过展示自噬促进了对线粒体代谢和赋予葡萄糖剥夺的细胞抗性的临界功能来阐明自噬保护机制。我们的研究因此揭示了一种新的治疗AKAP11选择性自噬的靶向治疗某些癌症。“
进一步探索












用户评论